题目内容
【题目】下列图象中,A、B是加热一定质量的高锰酸钾制氧气实验,C、D是用相同质量的双氧水制氧气实验,不能正确反映实验中对应变化关系的是( )
A.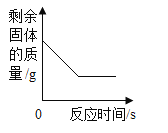
B.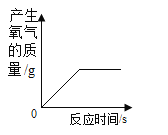
C.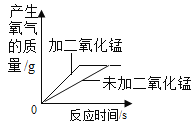
D.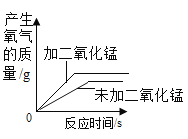
【答案】D
【解析】
A、高锰酸钾加热分解为锰酸钾、二氧化锰和氧气,生成物锰酸钾和二氧化锰都是固体,故固体的质量不会减少为零,故A正确,不符合题意;
B、加热一定量的高锰酸钾制氧气,完全反应后,生成的氧气的质量不再改变,故B正确,不符合题意;
C、用等质量等浓度的过氧化氢溶液在有无催化剂条件下制取氧气时,催化剂能够改变反应速率,但是不影响产生氧气的质量,故C正确,不符合题意;
D、用等质量等浓度的过氧化氢溶液在有无催化剂条件下制取氧气时,催化剂能够改变反应速率,但是不影响产生氧气的质量,故D不正确,符合题意。故选D。

【题目】常见金属在氧气中能剧烈燃烧。某化学探究小组对“铁丝在氧气中燃烧为什么会火星四射”有兴趣。于是进行了如下探究:
(提出问题)铁丝在氧气中燃烧会火星四射与哪些因素有关呢?
(猜想与假设)猜想一:可能与金属的沸点有关;猜想二:可能与氧气的浓度有关;猜想三:可能与铁中含碳量有关。
(查阅资料)镁的沸点为1107℃;铁的沸点为2705℃。
(设计并实验)该探究小组用将镁丝、纯细铁丝和两种不同含碳量的细铁丝(镁丝和铁丝直径均为0.4mm)分别放入空气和氧气中燃烧。记录燃烧时的现象如下表。
实验序号 | 氧气纯度(含氧量) | 镁丝 | 铁丝中含碳量 | 燃烧时的现象 |
① | 空气中(21%) | 剧烈燃烧,发出耀眼白光,无火星 | 0%(纯铁) | 不燃烧 |
② | 纯氧中(100%) | 更剧烈燃烧,发出耀眼白光,无火星 | 0%(纯铁) | 剧烈燃烧,无火星 |
③ | 纯氧中(100%) | 更剧烈燃烧,发出耀眼白光,无火星 | 0.05% | 剧烈燃烧,极少火星 |
④ | 纯氧中(100%) | 更剧烈燃烧,发出耀眼白光,无火星 | 0.6% | 剧烈燃烧,火星四射 |
(收集证据)(1)若要比较细铁丝燃烧的剧烈程度与氧气的纯度有关,应选择的实验编号组合是_____。由实验③和④对比可知,产生火星四射的现象与细铁丝中含碳量的关系:_____。
(解释与结论)(2)通过探究,了解细铁丝在纯净的氧气燃烧时会火星四射的原因。请写出细铁丝在氧气中燃烧生成黑色的四氧化三铁固体的化学方程式为:_____。
(3)细铁丝中含有不同的含碳量,碳元素在燃烧过程中生成二氧化碳气体,将反应生成的熔化物四氧化三铁推了出去,从而产生了火星四射的现象。为保证实验成功,选用的铁丝中含碳量要控制的范围为_____。
(4)取一段含碳量0.6%的细铁丝绕成螺旋状,投入盛有足量的稀盐酸的烧杯中充分反应,可观察的现象为_____,并在烧杯底有少量的黑色残渣,其化学式为C。
【题目】皮蛋又称松花蛋,因其风味独特,深受人们喜爱。某兴趣小组在市场上获得了少许腌制皮蛋的原料。拿到实验室进行实验。将该固体混合物放于烧杯中,缓慢加入足量的蒸馏水,充分溶解后过滤,得到白色沉淀A和无色澄清滤液B。
[提出问题] (1)白色沉淀 A是什么?
(2)无色滤液B中的溶质有哪些?
[查阅资料] (1)腌制皮 蛋的原料配方是少量NaCl、CaO和过量Na2CO3的固体混合物。
(2)氯化钠、硝酸钡水溶液显中性。
[理论推理] (1)白色沉淀 A是CaCO3,请写出生成该沉淀的化学方程式_____。
(2)滤液B中含有Na2CO3、NaOH、NaCl三种溶质。
[实验验证]为证明滤液 B中存在的三种溶质,同学们进行了如下实验。
步骤 | 实验操作 | 实验现象 | 实验结论 |
Ⅰ | 取少量滤液B于试管中,加入过量的Ba(NO3)2溶液,过滤 | _____ | 滤液B中含有Na2CO3、NaOH、NaCl |
Ⅱ | 取少量步骤I中所得滤液于试管中,加入酚酞溶液 | _____ | |
Ⅲ | 另取少量步骤I中所得滤液于试管中,先加入足量的稀硝酸,再加入_____溶液 | 产生白色沉淀 |
[拓展提升]
(1)向步骤I中加入过量Ba(NO3)2溶液的目的是_____。
(2)小妮同学认为若将步骤I中的Ba(NO3)2溶液换为BaCl2溶液,进行以上实验,最终也能证明滤液B中存在的三种溶质。你认为是否合理_____(填“合理”或“不合理”)。
(3)小轩同学认为向滤液B中先加入酚酞溶液,后加入过量的Ba(NO3)2溶液,也能得出滤液B的溶质中含有Na2CO3和NaOH的结论,你是_____(填“同意”或“不同意”)理由_____。
【题目】实验小组以鸡蛋壳(主要成分CaCO3,在水中能溶解出微量的Ca2+,其他成分对实验影响忽略不计)为牙齿的替代物,模拟含氟牙膏保护牙齿的化学原理。
(查阅资料)①含氟牙膏保护牙齿的原因:含氟牙膏中的NaF能与牙齿表面溶解的微量Ca2+反应,生成更难溶于酸的物质。
②常温下,酚酞溶液遇pH<8.2的碱性溶液不变色。
(进行实验)实验小组用2种不同的方法进行实验。
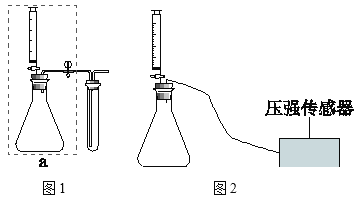
实验一:如图连接仪器,进行实验。
实验组 | 对照组 | |
锥形瓶中的物质 | 0.5g用含氟牙膏处理过的鸡蛋壳 | 0.5g未用含氟牙膏处理过的鸡蛋壳 |
注射器中的物质 | 20mL3.5%的盐酸 | m |
试管中的物质 | 滴有酚酞的氢氧化钠稀溶液 | 滴有酚酞的氢氧化钠稀溶液 |
试管中溶液褪色时间(s) | t1 | t2 |
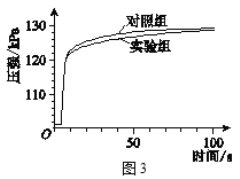
实验二:如图连接仪器,锥形瓶和注射器中的物质均与实验一相同。进行实验,测量压强随时间的变化
如图所示。
(解释与结论)
(1)装入药品前,检查装置a的气密性:用止水夹夹住右侧橡皮管,______,说明装置气密性良好。
(2)实验一中:
①鸡蛋壳中主要成分与盐酸反应的化学方程式为______。
②m处应填写的是______。
(3)实验二能证明含氟牙膏对鸡蛋壳有保护作用,其理由是______。由此推断出实验一中,t1______t2(填“>”、“<”或“=”)。
(反思与评价)
(4)根据本实验模拟的含氟牙膏保护牙齿的化学原理,推测下列摩擦剂一定不能用于制作含氟牙膏的是______(填序号)。
A CaCO3 B SiO2(二氧化硅) C Al(OH)3
【题目】某兴趣小组在学习氧气的化学性质时,发现不同物质在氧气中燃烧现象不同。

(1)下列物质在氧气中燃烧产物为气体的是_____(填序号)。
A.红磷 B.铁丝 C.木炭 D.硫粉
(2)铁丝在氧气中燃烧的化学方程式:_____。
(3)铁丝在氧气中燃烧没有火焰,而蜡烛在氧气中燃烧却有明亮的火焰。该小组同学进行了如下探究。
探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由_____(填“固态”或“气态”)物质燃烧形成的。
探究二:物质燃烧产生火焰的根本原因是什么?
(查阅资料)
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50∽70 | 300∽550 | 约600 |
铁 | 1535 | 2750 | 约1800 |
钠 | 97.8 | 883 | 约1400 |
由上表可知:物质燃烧能否产生火焰与其_____(填“熔点”或“沸点”)和燃烧时温度有关。通过上表中石蜡、铁的数据对比,你认为物质燃烧时,什么情况下能产生火焰_____。
由此推测:钠在燃烧时,_____(填“有”或“没有”)火焰产生。
(拓展应用)根据硫在空气或氧气中燃烧的实验事实,请你推测硫的沸点_____硫燃烧时的温度(填“>”或“<”或“=”)。