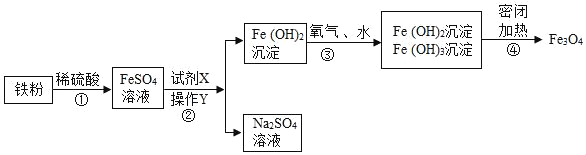
��Ŀ����
����Ŀ��Ϊ�˱Ƚ�������ͬpH��ϡ�����ϡ���ᷴӦ�Ŀ�����ij��ѧ��ȤС����������̽��ʵ�飮
��1������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ_____��
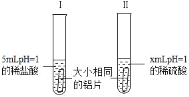
��2��x��_____��ѡ�����ֵ������_____��ʵ������У�����ͨ���۲�_____���Ƚ�����ϡ�����ϡ���ᷴӦ�ľ��ҳ̶ȣ�
��3��ʵ������У���������ϡ���ᷴӦ���Ӿ��ң�ͬѧ����������²��룺
����һ���Թܢ��������ӶԷ�Ӧ���˴ٽ����ã�
��������Թܢ�����������ӶԷ�Ӧ�����谭���ã�
���������������ֲ���ͬʱ������
Ϊ����֤���������Ƿ���ȷ�����Թܢ��м�������_____������ţ������Թܢ��м�������_____������ţ������Ա�ʵ�飮
A ����ͭ B �Ȼ��� C ������ D Ũ����
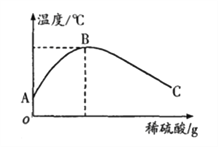
��4��ͨ����3���еĶԱ�ʵ�飬�۲쵽�Թܢ��з�Ӧ���������Ա仯���Թܢ��з�Ӧ���ԼӾ磬��_____���������
���𰸡�2Al+3H2SO4�TAl2��SO4��3+3H2�� 5 �Ա�ʵ��ֻ����һ������ ���ݲ����Ŀ��� C B һ
��������
��1������ϡ���ᷴӦ��������������������Ӧ�Ļ�ѧ����ʽΪ��2Al+3H2SO4�TAl2��SO4��3+3H2����
��2����Ϊ�Ա�����ֻ����һ������������x��5��ʵ������У�����ͨ���۲����ݲ����Ŀ������Ƚ�����ϡ�����ϡ���ᷴӦ�ľ��ҳ̶ȣ�
��3��Ϊ����֤���������Ƿ���ȷ�����Թܢ��м������������ƺ�Ӧ�ٶ��ޱ仯����Na+��SO42����ʵ��û��Ӱ�죮
���Թܢ��м��������Ȼ��Ʒ�Ӧ���Լӿ죬�ۺϿ�֪Na+��ʵ��ûӰ�죬����Ӱ��Ӧ���ʵ���Cl����
��4������3���еĶԱ����飬�۲쵽�Թܢ��з�Ӧ���������Ա仯���Թܢ��з�Ӧ���ԼӾ磬�����һ������
�𰸣�
��1��2Al+3H2SO4�TAl2��SO4��3+3H2����
��2��5���Ա�ʵ��ֻ����һ�����������ݲ����Ŀ�����
��3��C��B��
��4��һ��

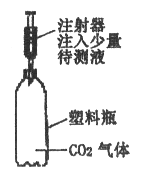
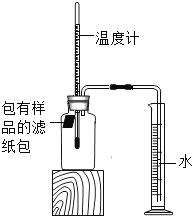
����Ŀ��С����������ʴ��������̽��������ʱ����������Ʒ����ֽ���ô�ͷ��̶��������ϣ�Ѹ��������װ����ͼ���۲쵽��Ͳ��ˮ�ص�������������ƿ�����ݻ�Ϊ146mL�������¶Ȼָ������£�����Ͳ��ˮ��߶Ȳ���ʱ��������ʱƿ��������������Ϊ�㣩����¼��ʼ��������Ͳ�Ķ����Լ�����ʱ�������
��� | ��Ʒ | ��Ͳ��ʼ ����/mL | ��Ͳ���� ����/mL | ����ʱ�� /min |
1 | 1g���ۡ�0.2g̼��10��ˮ | 100 | 70 | Լ120 |
2 | lg���ۡ�0.2g̼��10��ˮ������NaCl | 100 | 70 | Լ70 |
3 | ���� | 100 | 70 | Լ480 |
��1��ʵ��������˵��NaCl����_____����ʴ�����ʡ�
��2��ʵ�鿪ʼ���ƿ���¶�����������˵��������ʴ������_____������ȡ������ȡ������̡�
��3��ʵ�������ȡ����ֽ�����۲쵽�к���ɫ�������ɣ������ʵĻ�ѧʽ��_____��
��4����֪��̼�ܹ��ӿ����������ٶȣ�С����ͨ��ʵ����������̽��̼������ʴ���ʵ�Ӱ�죬���ڱ���հ״���дʵ��������Ʒ���_____��
��5����װ�û������ڲ��������������ĺ����������������ݼ������������������_____��С�������1λ����
����Ŀ��ʵ��������ƿ��ǩ�������ɫ��Һ�ס��ң�ֻ֪�����Ƿֱ���ϡ���������������Һ����ͬѧ��Ʋ�ͬ�����������ǡ���Ҫ��ش��������⣺
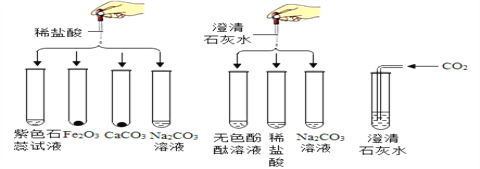
��1���ڲ�ѡ�����ָʾ����pH��ֽ������£�ѡ��ͬ�������ʽ������֡�
�����Լ� | ʵ������ͽ��� | ������Ӧ�Ļ�ѧ����ʽ | |
����һ | п�� | �����ݲ�������ϡ���ᣬ�����ݲ�����������������Һ | Zn+2HCl=ZnCl2+H2�� |
������ |
��2��ͬѧ���ڽ���ʵ�鷽��ʱ��С����Ƶġ��ö�����̼�������Լ���������һ�����ۡ������۵㣺�������𣻷����۵㣺������С����ͬ�����Ĺ۵㣬��������_______________��С������ͬ�����Ĺ۵㣬�����Ҳ��ͬ�Ļ�������ο���ͼװ��˵����֤�ķ�������Ҫд�������������ۣ���__________________��