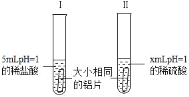
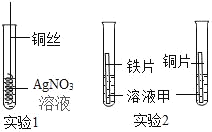
��Ŀ����
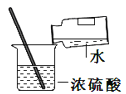
����Ŀ��Ϊ�˷������������ĺ�����ijѧϰС�������ʵ���о�����ȡ6g������10%�����ᷴӦ���������˼�������������ų����������Ĺ�ϵͼ����ͼ����

˵�������������ʲ�����ˮ���������ᷴӦ��
��1������ȫ��Ӧ��ȥ���������Ϊ_____g��
��2��������������������Ϊ���٣���д��������̣����������С�����һλ��_____��
��3��ijͬѧ�г������¼���ʽ������������պ÷�Ӧ��ȫʱ������Һ��������73+6��a��gС���Ըü���ʽ��������ɣ���ָ�����еĴ���_____��
���𰸡�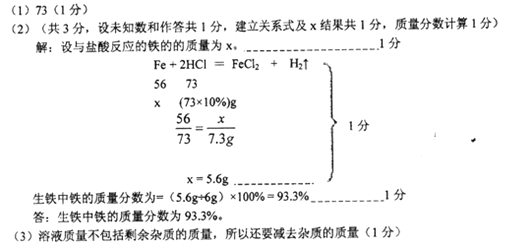
��������
��1������ȫ��Ӧ��ȥ�����������ͼʾ�п��Կ�����73g���ʴ�Ϊ��73
��2���⣺�������ᷴӦ����������Ϊx��
Fe+2HCl=FeCl2+H2��
56 73
x ��73��10%��g
![]()
��� x =" 5.6g"
������������������Ϊ=��5.6g��6g����100% = 93.3%
��������������������Ϊ93.3%��
��3������������պ÷�Ӧ��ȫʱ������Һ����Ӧ�����ʵ���������ȥ���������ʺ����ɵ������������
��Һ��������������������ʣ�����ʵ����������Ի�Ҫ��ȥ���ʵ�������

��ϰ��ϵ�д�
 �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�
�����Ŀ