题目内容
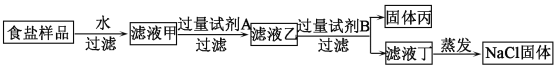
【题目】某食盐样品中含有少量泥沙、CaCl2和MgSO4,按下图方案提纯得到NaCl固体。
(1)写出试剂A与杂质反应的化学方程式_____。
(2)固体丙的主要成分是什么?_____
(3)以上方案还需完善,请说明原因并加以补充_____。
【答案】MgSO4+Ba(OH)2=Mg(OH)2![]() + BaSO4
+ BaSO4![]() 碳酸钙、碳酸钡 向滤液丁中加入适量的盐酸除去反应剩余的氢氧根离子和碳酸根离子,然后蒸发得到精盐
碳酸钙、碳酸钡 向滤液丁中加入适量的盐酸除去反应剩余的氢氧根离子和碳酸根离子,然后蒸发得到精盐
【解析】
由题意知,食盐样品加入水后过滤,把泥沙滤去,得到滤液甲,滤液甲中含有杂质CaCl2和MgSO4,可以先加入氢氧化钡溶液除去MgSO4杂质,过滤后,滤液乙中还含有氢氧化钡和CaCl2杂质,可用碳酸钠溶液除去这两种杂质,过滤后得到滤液丁,滤液丁中仍有氢氧化钠和碳酸钠,直接蒸发得到的氯化钠固体中仍有杂质。
(1)由分析得,试剂A为氢氧化钡,与杂质硫酸镁反应,其化学方程式为:MgSO4+Ba(OH)2=Mg(OH)2![]() + BaSO4
+ BaSO4![]() 。故填:MgSO4+Ba(OH)2=Mg(OH)2
。故填:MgSO4+Ba(OH)2=Mg(OH)2![]() + BaSO4
+ BaSO4![]() 。
。
(2)试剂B是碳酸钠,除去氯化钙和过量的氢氧化钡,碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠,碳酸钠与氢氧化钡溶液反应生成碳酸钡沉淀和氢氧化钠;因此固体丙的主要成分是反应生成的碳酸钙、碳酸钡。故填:碳酸钙、碳酸钡。
(3)由分析可知,滤液丁中仍有氢氧化钠和碳酸钠,直接蒸发得到的氯化钠固体中仍有杂质,要除去适量的氢氧化钠和碳酸钠,需要加入过量的盐酸,在加盐酸之前需要进行过滤,否则会引入新的杂质;故填:向滤液丁中加入过量的盐酸除去反应剩余的氢氧根离子和碳酸根离子,然后蒸发得到精盐。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】推理是学习化学的一种重要方法,但不合理的推理会得出错误的结论.请对下列错误观点用化学式或化学方程式写出相应的否定例证.
错误观点 | 否定例证 | |
① | 有单质和化合物生成的反应一定是置换反应 | 举例:CuO+CO |
② | 均一、稳定的液体一定是溶液 | __ |
③ | 含有碳元素的化合物一定是有机物 | __ |
④ | 生成盐和水的反应一定是中和反应 | __ |
【题目】妈妈买来一瓶管道通,商品标识如下表:
| 商品名 | 固体管道疏通剂 |
主要成分 | 氢氧化钠60% 碳酸钠15% | |
注意事项 | 不要与皮肤接触 | |
含量 | 600g |
小明欲测定标识中碳酸钠的含量是否属实,做了以下实验:取10g管道通样品,加入足量水,待完全冷却后滤去不溶物。向滤液中加入足量的氯化钙溶液,待完全反应后,过滤,洗涤、烘干,称量沉淀质量为2g,(假设管道通其他成分不参加化学反应)。请通过计算说明碳酸钠的标识是否属实___(请写出计算过程)