题目内容
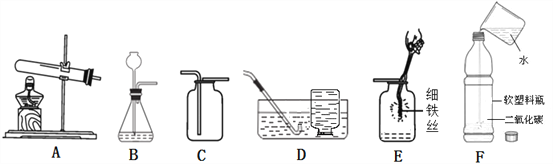
【题目】(1)已知碳酸氢钠(NaHCO3)受热分解生成碳酸钠、二氧化碳和水。某同学选用下图装置,用加热碳酸氢钠固体的方法制取二氧化碳。
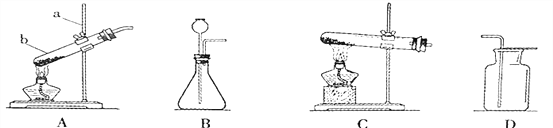
①仪器名称:a是_______,b是_______。
②加热碳酸氢钠制取二氧化碳的化学方程式为________,可选用_____(填标号)作为气体发生装置。
③用D装置收集二氧化碳,检验已集满的操作是_______。
(2)暖贴已逐步走进我们的生活。某品牌暖贴的标签如下图所示,其发热原因是铁锈蚀过程放出热量。

①铁锈的主要成分是_____。
②检验配料中含有铁粉。
用磁铁吸引黑色粉末,发现部分黑色粉末被吸引;取少量附着在磁铁上的粉末于试管中,加入适量稀硫酸,观察到_____________,确认配料中含有铁粉。
③探究暖贴中活性炭、氯化钠、水等物质的作用,实验数据如下:

a.活性炭粉末不用木炭粉末替代,原因是活性炭的________比木炭的强。
b.分析实验组____与对照组数据,证明氯化钠能加快的锈蚀速率。
c.请你把实验组4数据补充完整。________
d.设置实验组1的目的是___________。
【答案】 铁架台 试管 2NaHCO3![]() Na2CO3+H2O+CO2↑ C 用燃着的木条放在集气瓶口 氧化铁 铁粉表面有气泡产生,溶液由无色变为浅绿色 吸附作用 2 0、0.2 证明暖贴发热是铁锈蚀过程放出热量
Na2CO3+H2O+CO2↑ C 用燃着的木条放在集气瓶口 氧化铁 铁粉表面有气泡产生,溶液由无色变为浅绿色 吸附作用 2 0、0.2 证明暖贴发热是铁锈蚀过程放出热量
【解析】(1) ①根据常见仪器解答;②根据碳酸氢钠在加热的条件下分解生成碳酸钠、水和二氧化碳解答;③根据二氧化碳验满的方法解答;(2) ①根据铁生锈生成氧化铁解答;②根据铁与硫酸反应生成硫酸亚铁和氢气分析解答;③a根据活性炭吸附性比木炭强解答;bcd根据控制变量法分析解答。(1) ①仪器名称:a是铁架台,b是试管;②碳酸氢钠在加热的条件下分解生成碳酸钠、水和二氧化碳,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;可选用C作为气体发生装置;③用D装置收集二氧化碳,检验已集满的操作是用燃着的木条放在集气瓶口;(2) ①铁锈的主要成分是氧化铁;②铁与硫酸反应生成硫酸亚铁和氢气,观察到铁粉表面有气泡产生,溶液由无色变为浅绿色;③a活性炭粉末不用木炭粉末替代,原因是活性炭的吸附作用比木炭的强;b该组实验的变量是氯化钠,故选择实验组2与对照组数据,证明氯化钠能加快的锈蚀速率;c由表中实验组1、2、3可知,实验的变量分别是铁粉、食盐、水,故实验组4的变量为活性炭,因此活性炭的质量为0,食盐的质量不变为0.2;d实验组1的变量是铁粉,温度的上升值为0,故设置实验组1的目的是证明暖贴发热是铁锈蚀过程放出热量。
Na2CO3+H2O+CO2↑;可选用C作为气体发生装置;③用D装置收集二氧化碳,检验已集满的操作是用燃着的木条放在集气瓶口;(2) ①铁锈的主要成分是氧化铁;②铁与硫酸反应生成硫酸亚铁和氢气,观察到铁粉表面有气泡产生,溶液由无色变为浅绿色;③a活性炭粉末不用木炭粉末替代,原因是活性炭的吸附作用比木炭的强;b该组实验的变量是氯化钠,故选择实验组2与对照组数据,证明氯化钠能加快的锈蚀速率;c由表中实验组1、2、3可知,实验的变量分别是铁粉、食盐、水,故实验组4的变量为活性炭,因此活性炭的质量为0,食盐的质量不变为0.2;d实验组1的变量是铁粉,温度的上升值为0,故设置实验组1的目的是证明暖贴发热是铁锈蚀过程放出热量。

 阅读快车系列答案
阅读快车系列答案【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
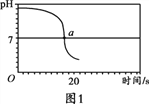
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。
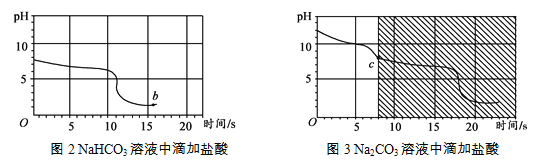
【解释与结论】
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为________。
【题目】同学们用Na2CO3溶液和浓盐酸来研究简易灭火器的反应原理时,对废液的成分进行探究。
【推理假设】上述两种物质发生反应的化学方程式为_________________,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
【实验探究】(1)确定废液中是否含有碳酸钠。某同学选用pH试纸测出废液的pH________7(选填“大于”、“小于”、“等于”),确定废液中一定含有Na2CO3。
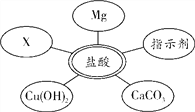
(2)确定废液中是否含有盐酸。①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X属于________(填物质类别);
②实验验证:某同学向废液中加入少量紫色石蕊溶液,观察到________________,确定废液中一定没有盐酸。
【拓展迁移】处理废液,回收利用,欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 分离方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是______ |
二 | 过量的________ | 蒸发结晶 | 可行 |