题目内容
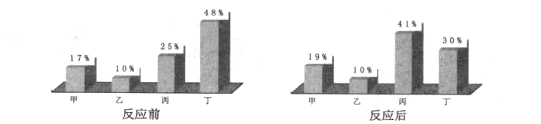
【题目】去年,美国商务部宣布,禁止美国公司向中兴公司销售电子技术和通讯元件,其中一个聚焦点就是芯片技术。生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是纯度极高的硅。
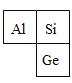
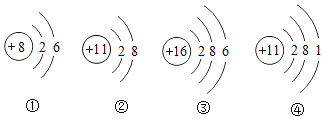
(1)硅和锗的组成元素在周期表中的位置如右图所示。则两种元素属于同一____填“周期”或“族”) ;
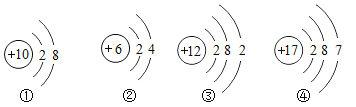
(2)已知硅原子结构示意图为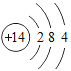 ,下面是四种粒子的结构示意图,其中与硅的化学性质相似的是___填序号);
,下面是四种粒子的结构示意图,其中与硅的化学性质相似的是___填序号);
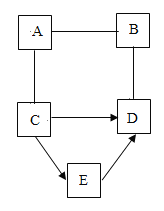
(3)高纯硅的制备以石英砂(主要成分是二氧化硅)为原料,生产过程示意图如下:
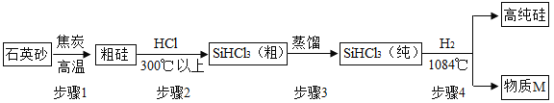
①上述四个步骤中属于物理变化的是_______。
②物质M是该生产过程中可循环使用的物质,写出步骤4反应的化学方程式______。
【答案】族 ② 步骤3(答“蒸馏”亦可得分) 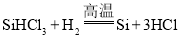
【解析】
根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息。
(1)根据硅和锗的组成元素在周期表中的位置,两种元素在一个竖列,所以属于同一族。故填:族。
(2)化学性质相似的原子的最外层电子数相同,由于硅原子最外层是4个电子,所以与之性质相似的也应该是四个最外层电子,给出的只有②符合要求。故选:②。
(3)①上述四个步骤,步骤1是二氧化硅和碳反应生成硅和一氧化碳,步骤2是硅和HCl反应生成 SiHCl3(粗,不纯),步骤3是 SiHCl3(粗,不纯)转化为 SiHCl3(纯),步骤4是 SiHCl3(纯)和氢气反应生成高纯硅,所以属于物理变化的是步骤3(蒸馏)。②步骤4反应是SiHCl3(纯)和氢气生成硅和物质M,而物质M是该生产过程中可循环使用的物质,根据质量守恒定律以及转化流程可知M为HCl,所以对应的化学方程式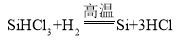 。故填:步骤3(答“蒸馏”亦可得分);
。故填:步骤3(答“蒸馏”亦可得分);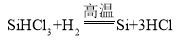 。
。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
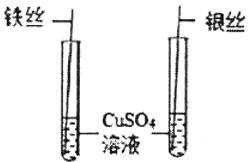
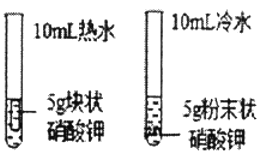
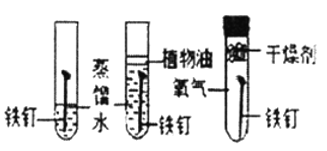
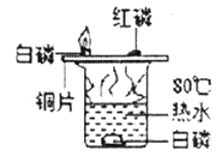
名牌学校分层周周测系列答案【题目】下列实验设计不能达到实验目的是( )
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. A B. B C. C D. D
【题目】2018年5月18日我国第一艘国产航母海试成功,航母的许多电子元件使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 39.92 | 59.84 | 79.80 | 99.80 |
(1)黄铜粉末完全反应生成氢气的总质量为__g。
(2)第三次实验后溶液中的溶质是___。
(3)该黄铜中铜的质量分数为多少__?(写 出计算过程)