题目内容
【题目】A、B 、C、D、E是初中常见的五种不同的物质。D是一种红色固体单质,C、D、E都含有同种金属元素,A是胃酸的主要成分,且与B反应生成白色沉淀。“一”表示两物质间相互能反应,“→”表示一种物质可直接生成另一种物质。回答下列问题:
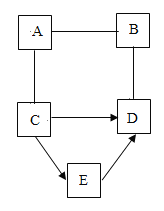
(1)C的化学式为_____。
(2)A-B的反应实质是_____。
(3)E→D的化学反应方程式是_____。
(4)B-D能发生反应的原因:_____。
(5)A物质的一种用途_____。
【答案】![]() 氯离子和银离子形成氯化银沉淀
氯离子和银离子形成氯化银沉淀 ![]() 铜的金属活动性比银的强 除铁锈
铜的金属活动性比银的强 除铁锈
【解析】
从题目已知,A是胃酸的主要成分,则A是盐酸,A与B反应生成白色沉淀,盐酸与硝酸银能生成氯化银白色沉淀,则B为硝酸银。D是一种红色固体单质,C、D、E都含有同种金属元素,则D是铜,A与C能反应,且C能生成铜,则C是氧化铜,氧化铜与盐酸反应生成氯化铜和水,氧化铜与还原性物质反应生成铜。氧化铜生成E,则E为铜盐,可以是硫酸铜或氯化铜等。
(1)C为氧化铜,化学式为![]() 。
。
(2)根据离子共存与不共存原则,A-B的反应实质是氯离子和银离子形成氯化银沉淀。
(3)E→D的化学反应方程式是![]() 。
。
(4)在金属活动性顺序中,活动性较强的金属能把活动性较弱的金属从其盐溶液中置换出来,所以B-D能发生反应的原因是铜的金属活动性比银的强。
(5)A是盐酸,它可以用于除铁锈。

【题目】已知烧杯中装有100g盐酸和氯化铜的混合溶液,其中含氯化铜8.1g。向烧杯中逐渐加入氧化铜,烧杯中溶液的质量与加入氧化铜的质量关系如下表。当恰好完全反应时,所得的溶液为不饱和溶液。
加入氧化铜的质量(克) | 0 | 2 | 4 | 6 | 8 | 10 |
烧杯中溶液的质量(克) | 100 | 102 | 104 | 106 | 108 | 108 |
请计算:
(1)恰好完全反应时消耗氧化铜的质量为__________g。
(2)求恰好完全反应时所得溶液的溶质质量分数(写出计算过程)。