题目内容
【题目】下列实验设计不能达到实验目的是( )
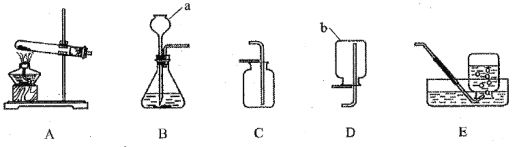
选项 | A | B | C | D |
实验目的 | 除去CO中的CO2,并回收CO | 探究可燃物燃烧所需的条件 | 除去氧化铜粉末中的铜粉 | 鉴别NH4NO3、CuSO4和NaCl三种白色粉末 |
实验设计 |
|
|
|
|
A. A B. B C. C D. D
【答案】C
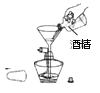
【解析】A、CO2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则;故能达到实验目的,故A错误;
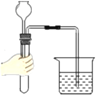
B、铜片上的白磷燃烧,红磷不燃烧,他们都与氧气接触,都获得了相同的温度,但是白磷能燃烧,而红磷不燃烧,可推知燃烧与温度是否达到可燃物的着火点有关;水中的白磷和薄铜片上的白磷的温度相同,水中的白磷不能与氧气接触,故水中的白磷不能燃烧,说明可燃物燃烧需要与氧气接触,故该实验可以达到目的。故B错误;
C、CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故该实验设计不能达到实验目的,故C正确;
D、NH4NO3溶于水吸热,使温度降低;CuSO4溶于水形成蓝色溶液,NaCl溶于水形成无色溶液,但温度几乎无变化,可以鉴别,故实验设计能达到实验目的,故D错误。故选C。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】某实验小组在做“用澄清石灰水检验二氧化碳”的实验时,发现一个有趣的实验现象:
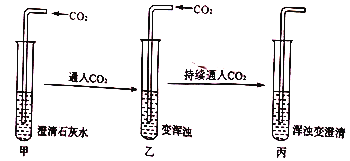
试管中浑浊现象为何消失?实验小组的同学对此实验进行了下列探究活动:
(1)根据已学知识,实验小组对CO2使澄清石灰水变浑浊的现象作出了合理的解释,其化学方程式为____________________。
(2)(查阅资料)
①碳酸盐一般不溶于水。如碳酸钙不溶于水。
②碳酸钙能与二氧化碳、水反应生成碳酸氢钙[Ca(HCO3)2],碳酸氢钙易溶于水。
③碳酸氢钙受热易分解,生成碳酸钙、二氧化碳、水。
从物质组成角度分类,碳酸氢钙应属于(_____)。
A.氧化物 B.酸 C.碱 D.盐
写出碳酸氢钙受热分解的化学方程式__________________________。
(3)(提出问题)碳酸氢钙能与哪些物质反应呢?
(4)(假设与猜想)猜想I:能与盐酸反应
猜想lI:能与氢氧化钠反应
……………
(5)(设计实验并验证)
实验步骤 | 实验现象 | 结论 |
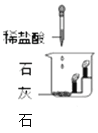
实验一:取丙中少量液体于试管中,滴加稀盐酸 | 有_________生成 | 猜想I成立 |
实验二:取丙中少量液体于试管中,滴加氢氧化钠溶液 | 有白色沉淀生成 | 猜想II成立 |
实验三:取丙中少量液体于试管中,加热 | 澄清液体又变浑浊 | 验证了资料描述 |
根据验证实验写出碳酸氢钙与盐酸反应的化学方程式______________。
(6)(讨论与反思)
该实验小组在实验中发现问题,并对问题进行不断探究。他们不但发现了新的物质,还了解了它的一些性质,并对生活中煮沸可以降低水的硬度、水垢的形成以及自然界中溶洞与钟乳石的形成有了更进一步的认识。