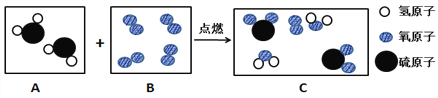
题目内容
【题目】(1)我们已经学习了氢氧化钠的性质,知道这种固体要密封保存,原因有:①___________________;②________________。
兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验:
【对固体猜想】
猜想I:全部是NaOH;猜想II:全部是Na2CO3;猜想III:是NaOH和Na2CO3混合物
【实验和推断】
(2)为进一步确定成分,进行了以下探究:
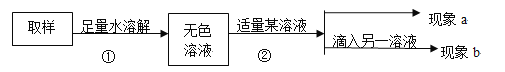
填写以下实验报告:
实验操作 | 实验现象 | 实验结论 |
第一步:用试管取约2mL该无色溶液,滴入适量澄清石灰水。 | 现象a:溶液变浑浊。 | 化学方程式:①___________, 证明有碳酸钠。 |
第二步:静置,取上层清液于另一试管中,滴入无色酚酞溶液。 | 现象b:②__________ | 证明含有NaOH,猜想III成立,是NaOH和Na2CO3混合物 |
③分析:小组中有同学提出质疑,认为以上实验不能证明猜想III成立,理由是:
a、Na2CO3溶液呈碱性; b、__________________________________________________。
(3)兴趣小组按下图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
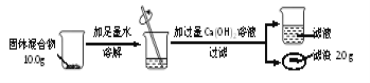
①根据题中信息______(填“能”或“不能”)计算Ca(OH)2溶液的质量分数。
②通过计算,固体混合物中Na2CO3的质量分数是__________________。
【答案】 氢氧化钠固体易潮解 CO2 + 2NaOH = Na2CO3 + H2O或氢氧化钠与空气中二氧化碳反应变质 Na2CO3+Ca(OH)2= 2NaOH+ CaCO3↓ 液体变红 第一步氢氧化钙溶液与碳酸钠溶液反应生成氢氧化钠,干扰第二步氢氧化钠的检验 不能 21.2%
【解析】(1)氢氧化钠固体要密封保存,原因有氢氧化钠固体易吸收空气中的水分,还和空气中的二氧化碳发生反应生成了碳酸钠而变质,故要密封保存;(2)①用试管取约2mL该溶液,滴入适量氢氧化钙溶液,振荡,碳酸钠溶液与氢氧化钙溶液反应生成了碳酸钙沉淀和氢氧化钠,证明有碳酸钠并全部除尽,反应化学方程式为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;②静置,取上层清液于试管中滴入酚酞溶液,振荡,酚酞变红,说明有氢氧化钠存在,猜想三成立,是NaOH和Na2CO3混合物;③Na2CO3溶液呈碱性,碳酸钠溶液与氢氧化钙溶液反应生成了氢氧化钠,也可以使酚酞变红,不能说明是原溶液中的氢氧化钠还是刚生成的氢氧化钠;为了排除氢氧化钙溶液与碳酸钠溶液反应生成氢氧化钠,干扰第二步氢氧化钠的检验,把第一步中的氢氧化钙溶液换成氯化钙溶液,可达到实验目的。(3) ①由于加入的氢氧化钙溶液质量未知,且本身过量,所以无法求算其质量分数;②设生成2.0g碳酸钙需要的碳酸钠的质量为![]()
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
![]() 2.0g
2.0g
![]()
![]() =2.12g
=2.12g
固体混合物中Na2CO3的质量分数为![]() 。
。
答:(1)根据题中信息不能计算Ca(OH)2溶液的溶质质量分数;(2)固体混合物中Na2CO3的质量分数为21.2%。

【题目】下列实验目的、操作、现象、结论都正确的是
选项 | 实验目的 | 实验操作 | 实验现象 | 实验结论 |
A | 测溶液pH | 用玻璃棒蘸取待测液滴在用蒸馏水润湿的pH试纸上 | 试纸变为浅红色 | 溶液pH为2 |
B | 鉴别NaOH和NH4NO3 | 在装有等量水的试管中分别加入a、b固体 | 加a的试管水温升高,加b的试管水温降低 | a是NaOH b是NH4NO3 |
C | 验证燃烧是否需要O2 |
| 前者不燃烧,后者燃烧 | 燃烧需要O2 |
D | 比较Al、Cu的活泼性 | 将未经打磨的Al条放入CuSO4溶液中 | 无明显现象 | 活泼性Al<Cu |
A. A B. B C. C D. D