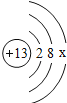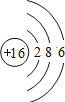题目内容
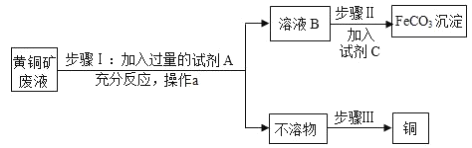
【题目】海水中含有丰富的氯化镁,如图是从海水中提取镁的简单流程.在提取Mg的过程中,
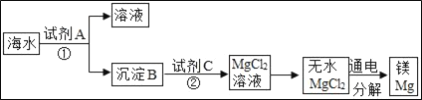
(1)试剂A最好选用_____(从我国有丰富的石灰石资源考虑).沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为_____;
(2)由无水MgCl2制取Mg的化学方程式为_____;
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:_____.
【答案】Ca(OH)2(氢氧化钙) Mg(OH)2 MgCl2![]() Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
【解析】
(1)试剂A最好选用氢氧化钙,这是因为氢氧化钙价格较低,并且制取氢氧化钙的原料丰富;
沉淀B是氢氧化镁,试剂C是稀盐酸,氢氧化镁和稀盐酸反应生成氯化镁和水,发生的是中和反应,氢氧化镁的化学式为Mg(OH)2.
故填:氢氧化钙;Mg(OH)2.
(2)由无水MgCl2制取Mg的化学方程式为:MgCl2![]() Mg+Cl2↑;
Mg+Cl2↑;
(3)海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液相比,海水中的MgCl2浓度低,并且含有多种杂质.
故填:海水中的MgCl2浓度低,并且含有多种杂质.

【题目】烧杯内原有某物质,向其中加入物质X,X的质量与变量Y的关系如图,下列一定能正确反应X、Y对应关系的是
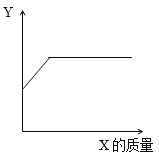
选项 | 烧杯内原有的物质 | X | Y |
A | 氯化钠溶液 | 氯化钠固体 | 溶液中溶质的质量分数 |
B | 水 | 硝酸铵固体 | 溶液的温度 |
C | 硫酸铜溶液 | 铁粉 | 溶液中溶质的质量 |
D | 稀硫酸 | 氧化铜 | 溶液中氧元素的质量 |
A. AB. BC. CD. D
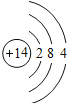
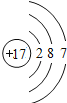
【题目】如图是第三周期部分元素的原子结构示意图,请根据题目要求填写下列空白.
第三周期 | Na | Al | Si | S | Cl |
(1)铝原子的质子数为_____,最外层电子数为_____,在化学反应中易失电子.
(2)当图中X=0时,则该粒子结构示意图表示的是_____;(填粒子符号)
(3)由第三周期元素组成AB4型化合物,其化学式可能是_____.
(4)图中同一周期元素原子的一条变化规律是_____.