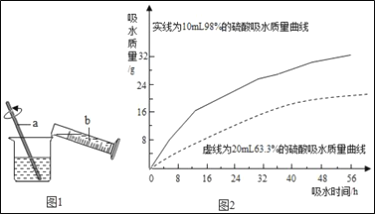
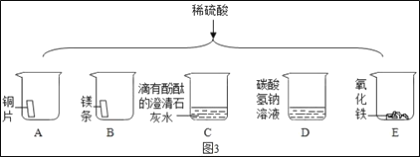
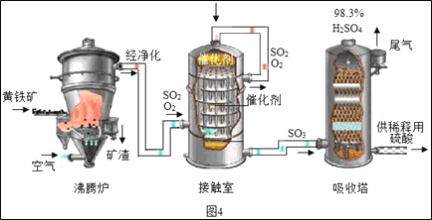
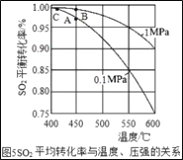
题目内容
【题目】(3分)如图所示为①硝酸钾②氯化钠③硼酸(H3BO3)的溶解度曲线图。由图可知:
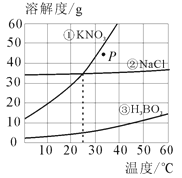
(1)当温度为10℃时,硝酸钾、氯化钠和硼酸三种物质的溶解度由小到大的顺序为 (请用序号作答)。
(2)当温度为25℃时,上述三种物质的饱和溶液中,溶质的质量分数由小到大的顺序为 (请用序号作答)。
(3)要将P点处的硝酸钾溶液变成饱和溶液,可采取的措施有:加入硝酸钾固体、 (任写一条)等。
【答案】(1)③<①<② (2)③<①=② (3)蒸发溶剂或降低温度
【解析】
试题分析:(1)根据溶解度曲线,当温度为10℃时,硝酸钾、氯化钠和硼酸三种物质的溶解度由小到大的顺序为:③<①<②
(2)根据溶解度曲线当温度为25℃时,硝酸钾、氯化钠和硼酸三种物质的溶解度大小关系是:①=②>③,故三种物质的饱和溶液中,溶质的质量分数由小到大的顺序为③<①=②
(3)根据溶解度曲线,硝酸钾的溶解度随温度的升高而增大,故要将P点处的硝酸钾不饱和溶液变成饱和溶液,可采取的措施有:加入硝酸钾固体、蒸发溶剂或降低温度

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】现有一包白色粉末,可能由NH4Cl、Na2CO3、NaHCO3中的一种或几种组成。小莹为了探究其成分,进行了如下实验:
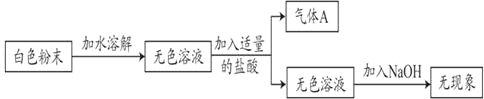
(1)由上述实验可知气体A是_____。
(2)根据上述的实验现象,原白色粉末一定没有_____。
(3)(发现问题)Na2CO3、NaHCO3与盐酸反应,均能产生气体,无法确定固体的成分。
(查阅资料)
①NaHCO3与可溶性的钙盐、钡盐混合没有沉淀产生。
②NaHCO3与足量的Ca(OH)2反应有白色沉淀产生。
(提出猜想)
猜想1:白色粉末只有_____;
猜想2:白色粉末只有Na2CO3;
猜想3:白色粉末是_____。
(实验探究)
小勇为了验证其猜想,取少量的白色粉末放入烧杯中,加水全部溶解后,加入足量的Ca(OH)2溶液,现象是_____,他就认为猜想二正确。小杰认为小勇的结论不正确,理由是_____,
于是他做了进一步的探究:
实验操作 | 现象 | 实验结论 |
取白色粉末于烧杯中,加水溶解,再加入BaCl2溶液充分搅拌,静置 | 若无_____现象 | 猜想_____成立 |
若_____ | 证明白色固体肯定有_____,可能有_____ | |
取10.6g白色粉末于锥形瓶中,加入足量稀盐酸后把生成的气体通入足量的NaOH溶液中,反应完全后称得NaOH溶液增重4.5g | 确认猜想_____成立 |
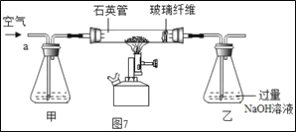
【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
(查阅资料)
a.固体酒精也被称为"酒精块"或固体燃料块。固体酒精并不是固体状态的酒精而是将酒精、硬脂酸和氢氧化钠按一定的质量比混合制成。
b.酒精的化学式为C2H5OH;
c.氯化钡、氯化钠溶液均呈中性。
d. BaCl2+Na2CO3=BaCO3↓+2NaCl 生成的BaCO3为白色固体
(提出问题)
(1)酒精的化学式与NaOH相比,都有“OH”,那么酒精的水溶液是不是显碱性?
(2)固体酒精中的氢氧化钠是否变质及变质的程度如何?
(实验探究1)酒精的水溶液是不是显碱性
同学们取少量酒精溶液于试管中,滴加紫色石蕊溶液,未观察到紫色石蕊变为蓝色,说明酒精溶液_______(填“显”或“不显”)碱性。
(实验探究2)固体酒精中的氢氧化钠是否变质及变质的程度如何
①固体酒精中的氢氧化钠是否变质,同学们先取少量固体酒精于烧杯中,加入足量水溶解后滴加足量的稀盐酸,观察到__________现象,说明氢氧化钠已变质.请写出氢氧化钠在空气中变质的化学方程式______________。
②为进一步确定氢氧化钠的变质程度,分组进行探究。
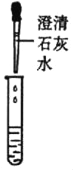
甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生__ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是__。他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是________。
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。