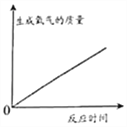
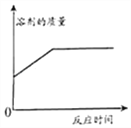
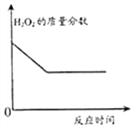
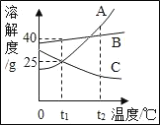
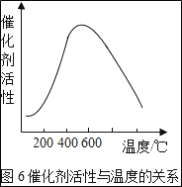
题目内容
【题目】中国环保部和国家标准委两个部门方便向WTO递交通知,宣布从2017年9月起,中国将禁止进口有关“洋垃圾”,力图减少环境污染,如电路板含有以下金属:Sn、Pb、Cu、Ag、Ni(镍,银白色)、Pd(钯,银白色),如果不回收,既是资源浪费,又会造成环境污染,如图是回收其中部分金属的流程图。(假设流程图中各反应均恰好完全反应,已知:2Cu+O2+2H2SO4![]() 2CuSO4+2H2O)
2CuSO4+2H2O)

(1)写出红色固体A的名称_____。
(2)滤渣2中含有的金属是_____。
(3)步骤⑤反应的化学方程式_____。
(4)步骤⑥回收的纯净物B是_____(写化学式)。
(5)金属Ni的活动性比铁_____(填“强”或“弱”)。
(6)在①﹣⑥步操作过程中,使用次数最多的玻璃仪器是_____。
【答案】铜 Sn、Pb、Ni Fe+CuSO4=FeSO4+Cu FeSO4 弱 玻璃棒
【解析】
金属板加入足量的稀硫酸得到滤渣1和滤液1,滤渣1中加入稀硫酸、氧气控制温度加热,得到银、金、钯和滤液3,滤液3中加入铁粉会生成红色固体A,所以A是铜,滤渣1中含有银、金、钯、铜,滤液3是硫酸铜,滤液4是硫酸亚铁,所以铁、锡、铅、镍排在氢之前,滤液1中加铁得到硫酸亚铁和滤渣2,所以滤渣2中是锡、镍和铅;
(1)A是铜,故填:铜;
(2)滤渣2中含有的金属是:Sn、Pb、Ni;故填:Sn、Pb、Ni;
(3)步骤⑤是铁与硫酸铜反应生成硫酸亚铁和铜,故填:Fe+CuSO4=FeSO4+Cu;
(4)通过推导可知,步骤⑥回收的纯净物B是FeSO4;故填:FeSO4;
(5)金属Ni的活动性比铁要弱,故填:弱;
(6)在①﹣⑥步操作过程中,使用次数最多的玻璃仪器是玻璃棒,故填:玻璃棒。

【题目】现有一包白色粉末,可能由NH4Cl、Na2CO3、NaHCO3中的一种或几种组成。小莹为了探究其成分,进行了如下实验:
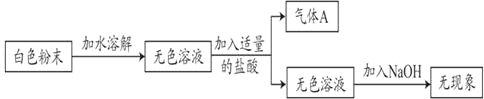
(1)由上述实验可知气体A是_____。
(2)根据上述的实验现象,原白色粉末一定没有_____。
(3)(发现问题)Na2CO3、NaHCO3与盐酸反应,均能产生气体,无法确定固体的成分。
(查阅资料)
①NaHCO3与可溶性的钙盐、钡盐混合没有沉淀产生。
②NaHCO3与足量的Ca(OH)2反应有白色沉淀产生。
(提出猜想)
猜想1:白色粉末只有_____;
猜想2:白色粉末只有Na2CO3;
猜想3:白色粉末是_____。
(实验探究)
小勇为了验证其猜想,取少量的白色粉末放入烧杯中,加水全部溶解后,加入足量的Ca(OH)2溶液,现象是_____,他就认为猜想二正确。小杰认为小勇的结论不正确,理由是_____,
于是他做了进一步的探究:
实验操作 | 现象 | 实验结论 |
取白色粉末于烧杯中,加水溶解,再加入BaCl2溶液充分搅拌,静置 | 若无_____现象 | 猜想_____成立 |
若_____ | 证明白色固体肯定有_____,可能有_____ | |
取10.6g白色粉末于锥形瓶中,加入足量稀盐酸后把生成的气体通入足量的NaOH溶液中,反应完全后称得NaOH溶液增重4.5g | 确认猜想_____成立 |