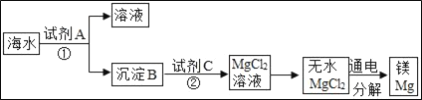
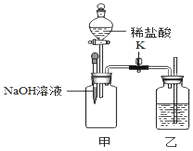
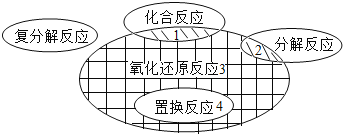
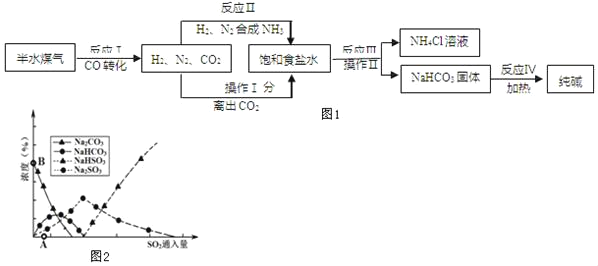
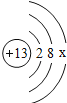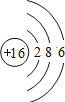题目内容
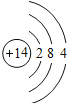
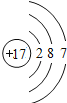
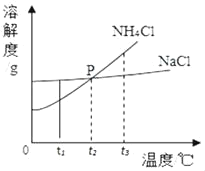
【题目】如图是第三周期部分元素的原子结构示意图,请根据题目要求填写下列空白.
第三周期 | Na | Al | Si | S | Cl |
(1)铝原子的质子数为_____,最外层电子数为_____,在化学反应中易失电子.
(2)当图中X=0时,则该粒子结构示意图表示的是_____;(填粒子符号)
(3)由第三周期元素组成AB4型化合物,其化学式可能是_____.
(4)图中同一周期元素原子的一条变化规律是_____.
【答案】13 3 Al3+ SiCl4 从左向右,核电荷数依次增加(合理答案给分)
【解析】
(1)根据原子结构示意图各部分的含义可知铝原子的质子数为13,同一原子中,质子数=核外电子数,最外层电子数为3;
(2)当X=0时,说明该原子失去了三个电子,带三个单位的正电荷,离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右,电荷数为1时,1不写,所以该粒子符号为Al3+;
(3)化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写。组成AB4型化合物的A元素显+4价,B元素显﹣1价,则只有硅元素和氯元素,因此化学式为SiCl4 ;
(4)根据原子结构示意图可看出,图中同一周期元素原子的一条变化规律是:从左向右,核电荷数依次增加,最外层电子数从1递增到7等规律。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】兴趣小组同学对“氢氧化钠溶液与稀硫酸混合是否发生了化学反应”进行了如下探究:
【提出问题】氢氧化钠溶液与稀硫酸混合是否发生了化学反应?
【猜想与假设】
a:二者混合发生了化学反应;
b:二者混合没有发生化学反应。
【设计并实验】
实验操作 | 实验现象 | |
甲同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,用胶头滴管慢慢滴入1-2滴稀硫酸,振荡,同时测定溶液的pH | 溶液pH减小但仍大于7 |
乙同学 | 向盛有10mL一定溶质质量分数的氢氧化钠溶液的烧杯中,先滴入几滴无色酚酞试液,然后再加入稀硫酸 | 溶液由红色变为无色 |
【得出结论】氢氧化钠溶液与稀硫酸发生了化学反应。
(1)乙同学认为甲的实验设计不合理,原因是_____________,改进的方法是____________;根据改进后的实验现象说明二者混合后发生了化学反应,写出氢氧化钠溶液与稀硫酸反应的化学方程式__________;甲同学也认为乙的实验设计也不合理,你是否赞同,说出你的理由___________。
【思考与交流】
丙同学在绝热装置中,向分别盛有10mL10%氢氧化钠溶液加入不同体积某浓度的稀硫酸,充分混合后溶液的温度变化曲线如图(混合前稀硫酸和氢氧化钠溶液均为18℃)。
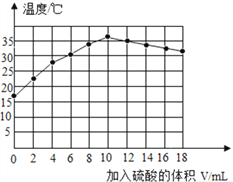
(2)根据图示分析,稀硫酸和氢氧化钠的反应是__________(填吸热、放热)反应,加入稀硫酸_________mL时,二者恰好完全反应.