��Ŀ����
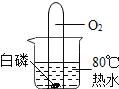
����Ŀ��̼��������FeCO3������ȡ��Ѫ����ԭ�ϣ��������û�ͭ���Һ[���ʳɷ�ΪFe2��SO4��3��CuSO4��H2SO4]Ϊԭ�ϣ��Ʊ�̼������������ͭ����������ʾ��ͼ��
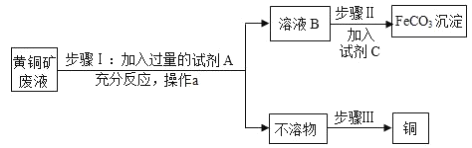
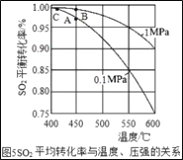
��֪����Fe��Fe2��SO4��3��Һ�ܷ�����Ӧ����FeSO4����ҺB��ֻ��һ�����ʡ�
��1������1�У��Լ�AΪ_____���������A��Ŀ����ʹ��Һ��Fe2��SO4��3��CuSO4��H2SO4ȫ��ת��Ϊ_____����Ӧ�����й۲쵽������֮һ���к�ɫ����������д���÷�Ӧ�Ļ�ѧ����ʽ_____��
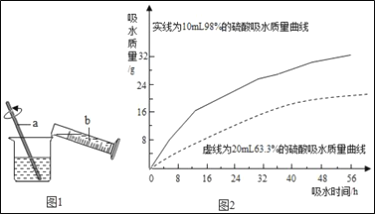
��2������a�����ƣ�_____��
��3��������У��Լ�C�Ļ�ѧʽ����Ϊ_____�ȿ�����̼���Ρ�
��4��������Ŀ���ǣ���ȥ�����������е���һ�ֽ��������յõ������������ͭ���û�ѧ��������ͭ�IJ�������Ϊ�����������ϡ������ᡢ���ˡ�ϴ�ӡ��������ͭ����������Ϊ_____��
���𰸡��� FeSO4 Fe+CuSO4��Cu+FeSO4 ���� Na2CO3�ȿ�����̼���� ��������
��������
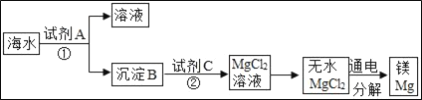
��1�����������Ʊ�̼��������ͭ������Ϊ���������µ����ʣ�����1�У��Լ�AΪ ������������
�������A��Ŀ����ʹ��Һ��Fe2��SO4��3��CuSO4��H2SO4ȫ��ת��Ϊ������������������������
��Ӧ�����й۲쵽������֮һ���к�ɫ��������������������ͭ��Ӧ��������������ͭ���ʷ�Ӧ�Ļ�ѧ����ʽдΪ�� Fe+CuSO4��Cu+FeSO4��
��2������aʵ���˹����Һ��ķ��룬�ò���Ϊ���ˣ�������ˡ�
��3���������������������Cת������̼�����������������غ㶨���Լ����ֽⷴӦ���ڷ�Ӧ�������������ɲ��ܣ������趼�ܡ��������Լ�C�Ļ�ѧʽ����Ϊ Na2CO3�ȿ�����̼���Σ�����Na2CO3�ȿ�����̼���Ρ�
��4����������������������ͭ�����Ի���ͭ����������Ϊ�����������������������

����Ŀ��������ҹ���������ʳ����ʷ�ƾá�������õ�һ��ȼ���ǹ���ƾ���ij��ѧ��ȤС���ͬѧ��������ƾ��������˺��棬����ɷֽ���̽��������ش��������⡣
���������ϣ�
a������ƾ�Ҳ����Ϊ"�ƾ���"�����ȼ�Ͽ顣����ƾ������ǹ���״̬�ľƾ����ǽ��ƾ���Ӳ֬����������ư�һ���������Ȼ���Ƴɡ�
b���ƾ��Ļ�ѧʽΪC2H5OH��
c.�Ȼ������Ȼ�����Һ�������ԡ�
d. BaCl2+Na2CO3=BaCO3��+2NaCl ���ɵ�BaCO3Ϊ��ɫ����
��������⣩
(1)�ƾ��Ļ�ѧʽ��NaOH��ȣ�������OH������ô�ƾ���ˮ��Һ�Dz����Լ��ԣ�
(2)����ƾ��е����������Ƿ���ʼ����ʵij̶���Σ�
��ʵ��̽��1���ƾ���ˮ��Һ�Dz����Լ���
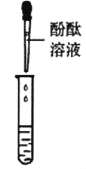
ͬѧ��ȡ�����ƾ���Һ���Թ��У��μ���ɫʯ����Һ��δ�۲쵽��ɫʯ���Ϊ��ɫ��˵���ƾ���Һ_______(������������������)���ԡ�
��ʵ��̽��2������ƾ��е����������Ƿ���ʼ����ʵij̶����
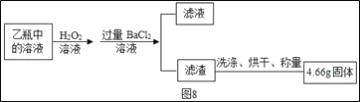
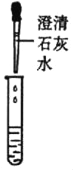
�ٹ���ƾ��е����������Ƿ���ʣ�ͬѧ����ȡ��������ƾ����ձ��У���������ˮ�ܽ��μ�������ϡ���ᣬ�۲쵽__________����˵�����������ѱ��ʣ���д�����������ڿ����б��ʵĻ�ѧ����ʽ______________��
��Ϊ��һ��ȷ���������Ƶı��ʳ̶ȣ��������̽����
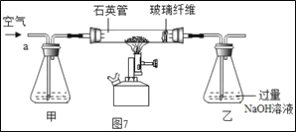
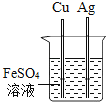
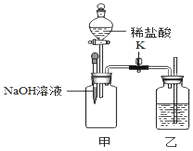
����ͬѧȡ�ձ��ϲ���Һ����֧�Թ��У�����ͼ��ʾ����ʵ�顣
ʵ�鷽�� |
|
|
ʵ������ | ��Һ��� | ����__ |
ʵ����� | ��Һ������������ | ��Һ����̼���� |
����ͬѧ��Ϊ����ʵ�鲻��֤����Һ��һ�����������ƣ�������__��������ȡ�ձ����ϲ���Һ���������Ȼ�����Һ����ַ�Ӧ���ã�ȡ�ϲ���Һ���μӷ�̪��Һ����̪��Һ��졣
����˼����������ʵ���м������Ȼ�����Һ��Ŀ����________��
��ʵ�����]С��ͬѧ�������ۣ�һ����Ϊ�ù���ƾ��е��������Ʋ��ֱ��ʡ�