题目内容
【题目】学习完碱的相关知识后,某兴趣小组对“二氧化碳与碱的反应”进行了探究。
(1)甲、乙两位同学分别进行了如下实验:
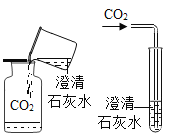
甲同学向盛有二氧化碳的集气瓶中倒入澄清石灰水,观察到石灰水先变浑浊,后变澄清;乙同学将二氧化碳通入到澄清石灰水中,观察到石灰水变浑浊。你认为____________同学的实验能验证氢氧化钙的性质,反应的化学方程式为________________。
(2)实验小组同学又将CO2通入某浓度的氢氧化钠溶液中,一段时间后,发现有固体析出。
(提出问题)析出固体的成分是什么?
(猜想与假设)同学们提出以下猜想:
猜想A:Na2CO3;
猜想B:NaHCO3;
猜想C:________________________
(进行实验)甲同学取少量固体溶于水,滴加无色酚酞溶液,溶液变红,则认为猜想A正确;乙同学认为甲同学的实验不合理,理由是________________________。
乙同学设计了以下方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
①取少量固体于试管中,加水充分溶解后,加入过量的_________溶液 | 无明显现象 | 猜想B正确 |
②在①溶液中加入稀盐酸 | _____________________ |
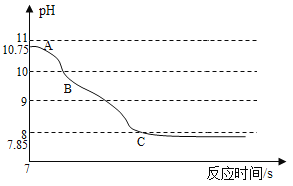
(反思交流)该小组同学将二氧化碳通入氢氧化钠溶液中,利用数字化技术测定溶液pH值变化,待完全反应后,观察到溶液中逸出大量气泡,pH出现两段S型变化曲线。
(实验分析)(3)AB段变化的原因可能是_____________________________________。BC段变化的原因可能是_______________。利用实验验证变化后的产物,实验操作为______________________.实验现象是________________.
【答案】乙 Ca(OH)2+CO2=CaCO3↓+H2O 碳酸钠和碳酸氢钠的混合物 碳酸氢钠溶液也显碱性 氢氧化钙 先无现象,后有气泡产生 二氧化碳和氢氧化钠反应生成碳酸钠和水,碱性减弱 二氧化碳、水和碳酸钠反应生成碳酸氢钠,碱性继续减弱 取最后段的液体加热至沸腾,将气体通入澄清石灰水 澄清石灰水变浑浊
【解析】
(1)氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,甲同学向盛有二氧化碳的集气瓶中倒入澄清石灰水,观察到石灰水先变浑浊,后变澄清,氢氧化钙是过量的,最后生成了溶于水的碳酸氢钙,乙同学将二氧化碳通入到澄清石灰水中,观察到石灰水变浑浊,二氧化碳是过量的,最后生成了碳酸钙,所以乙同学的实验能验证氢氧化钙的性质,化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(2)[猜想与假设]二氧化碳和氢氧化钠反应生成碳酸氢钠,二氧化碳和碳酸氢钠反应生成碳酸钠和水,所以猜想C是碳酸钠和碳酸氢钠的混合物;
[进行实验]碳酸钠、碳酸氢钠在溶液都显碱性,所以乙同学认为甲同学的实验不合理,理由是:碳酸氢钠在溶液中也显碱性;
碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,碳酸氢钠和酸反应的二氧化碳,所以
实验步骤 | 实验现象 | 实验结论 |
①取少量固体于试管中,加水充分溶解后,加入过量的氢氧化钙溶液 | 无明显现象 | 猜想B正确 |
②在①溶液中加入稀盐酸 | 先无现象,后有气泡产生 |
(3)二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳、水和碳酸钠反应生成碳酸氢钠,氢氧化钠的碱性最强,碳酸氢钠的碱性最弱,所以
AB段变化的原因可能是二氧化碳和氢氧化钠反应生成碳酸钠和水,碱性减弱;
BC段变化的原因可能是二氧化碳、水和碳酸钠反应生成碳酸氢钠,碱性继续减弱;
碳酸氢钠受热易分解生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,所以利用实验验证变化后的产物,实验操作为取最后段的液体加热至沸腾,将气体通入澄清石灰水,实验现象是澄清石灰水变浑浊,实验结论是变化后的产物是碳酸氢钠。
故答案为:(1)乙,Ca(OH)2+CO2=CaCO3↓+H2O;
(2)[猜想与假设]碳酸钠和碳酸氢钠的混合物;
[进行实验]碳酸氢钠在溶液中也显碱性;
实验步骤 | 实验现象 | 实验结论 |
①氢氧化钙 | ||
先无现象,后有气泡产生 |
(3)二氧化碳和氢氧化钠反应生成碳酸钠和水,碱性减弱;
二氧化碳、水和碳酸钠反应生成碳酸氢钠,碱性继续减弱;
取最后段的液体加热至沸腾,将气体通入澄清石灰水;澄清石灰水变浑浊。