题目内容
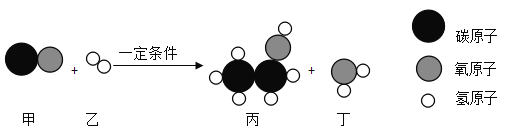
【题目】服用含![]() 的抗酸药可治疗胃酸过多症,有关反应的化学方程式为_____________;实验室有碳酸镁和碳酸钙的固体混合物100
的抗酸药可治疗胃酸过多症,有关反应的化学方程式为_____________;实验室有碳酸镁和碳酸钙的固体混合物100![]() ,使之与500
,使之与500![]() 质量分数为20%的盐酸充分反应,将反应后的溶液蒸干得到112.1
质量分数为20%的盐酸充分反应,将反应后的溶液蒸干得到112.1![]() 固体。则原混合物中金属元素的质量分数为____________。
固体。则原混合物中金属元素的质量分数为____________。
【答案】![]() 34%
34%
【解析】
胃酸的主要成分是盐酸,碳酸镁能和盐酸反应生成氯化镁、水和二氧化碳,从而除去过多的胃酸,该反应的方程式为:![]() ;
;
碳酸镁和碳酸钙的固体混合物,与足量盐酸充分反应;碳酸镁和碳酸钙与盐酸反应的化学方程式分别为![]() 、
、![]() ,由上述化学方程式可知,碳酸镁和碳酸钙与盐酸完全反应后,生成的固体可看成碳酸根离了被两个氯离子取代,两个氯离子的相对原子质量的和是71,一个碳酸根的相对质量是60,差是11.即完全反应后质量增加了11份质量,实际反应后固体质量增加了
,由上述化学方程式可知,碳酸镁和碳酸钙与盐酸完全反应后,生成的固体可看成碳酸根离了被两个氯离子取代,两个氯离子的相对原子质量的和是71,一个碳酸根的相对质量是60,差是11.即完全反应后质量增加了11份质量,实际反应后固体质量增加了![]() 。
。
设原混合物中含碳酸根的质量为![]() ,可列式:
,可列式:

![]()
解得:![]() ,则混合物中所含金属元素质量为
,则混合物中所含金属元素质量为![]() ,
,
故金属元素的质量分数为![]() 。
。

【题目】实验室有一小瓶实验课后剩余的固体![]() ,其中可能混有少量
,其中可能混有少量![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或两种杂质。为了不浪费药品,实验小组在老师的指导下进行了如下实验。下图为同学们可能进行过的一些操作
中的一种或两种杂质。为了不浪费药品,实验小组在老师的指导下进行了如下实验。下图为同学们可能进行过的一些操作
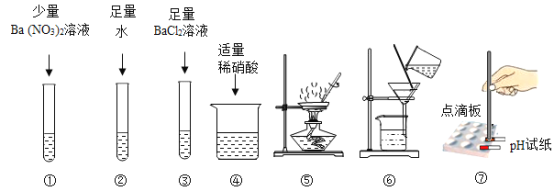
(实验一)取少量固体于试管中,依次进行以下实验确定杂质的成分
步骤 | 上图实验编号 | 实验现象 |
1 | ____________ | 得到无色澄清溶液 |
2 | ③、④ | 开始有白色沉淀,后来不再产生白色沉淀 |
3 | ①或_______ | (略) |
实验结论:![]() 固体中只有
固体中只有![]() 和
和![]() 两种杂质。
两种杂质。
(实验二)除去杂质,得到![]() 溶液作为氮肥施用到校园的花园里。
溶液作为氮肥施用到校园的花园里。
同学们经过讨论认为实验过程中加入的稀硝酸必须足够但不宜过多,为更好地控制稀硝酸的用量,应采用以下具体操作:
把瓶内固体全部倒入烧杯中,加足量水使固体全部溶解,先进行上图实验__________(填编号),再进行上图实验④至____________________________________________________(填现象)。
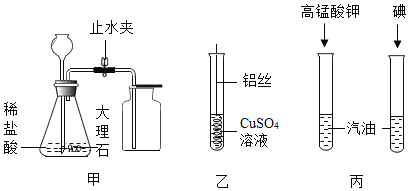
【题目】某化学兴趣小组同学取某地的石灰石和一定浓度的稀盐酸来制备二氧化碳。请你参与研究并按要求回答下列问题:
(1)下面是实验桌上摆放好的该实验所需的仪器,小明发现其中缺少了一种必需的玻璃仪器是__________;若要组装一套制取并收集二氧化碳的装置,还要选择的仪器是_______________(填仪器下方的字母),此装置还可以用于实验室制取氧气,其化学方程式为____________________。
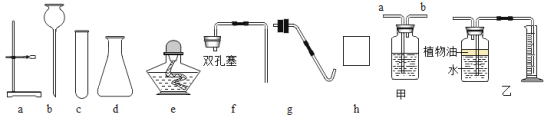
(2)若用上图甲装置干燥生成的![]() ,甲瓶中应该装入的药品是____________;若用乙装置测量二氧化碳气体的体积,乙中植物油作用是____________________。
,甲瓶中应该装入的药品是____________;若用乙装置测量二氧化碳气体的体积,乙中植物油作用是____________________。
(3)小明想弄清楚这种石灰石的纯度,于是取10![]() 石灰石样品粉碎后放入锥形瓶中,并加入了86.6
石灰石样品粉碎后放入锥形瓶中,并加入了86.6![]() 10%的稀盐酸(杂质不与酸反应,也不溶于水),充分反应后锥形瓶中的剩余物的质量为93.3
10%的稀盐酸(杂质不与酸反应,也不溶于水),充分反应后锥形瓶中的剩余物的质量为93.3![]() 。小明提出了如下计算思路:用加入盐酸的质量乘以盐酸的质量分数,求出盐酸的溶质质量,进而利用化学方程式求出石灰石中碳酸钙的质量。你认为小明的思路是否可行,理由是____________________。
。小明提出了如下计算思路:用加入盐酸的质量乘以盐酸的质量分数,求出盐酸的溶质质量,进而利用化学方程式求出石灰石中碳酸钙的质量。你认为小明的思路是否可行,理由是____________________。
通过讨论后,你计算出此石灰石中碳酸钙的质量分数为____________________。
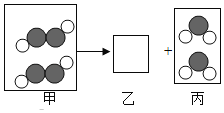
(4)老师利用同学们制取的![]() 表演了“通气生火”的魔术。用棉花将一种淡黄色的固体包裹其中,将导气管插入棉花团中通入
表演了“通气生火”的魔术。用棉花将一种淡黄色的固体包裹其中,将导气管插入棉花团中通入![]() 气体,稍后棉花团剧烈燃烧起来。同学们为了揭开这个魔术的秘密,进行了如下探究。
气体,稍后棉花团剧烈燃烧起来。同学们为了揭开这个魔术的秘密,进行了如下探究。
(相关信息)①淡黄色固体成分是过氧化钠(![]() )。
)。
②通入的气体主要成分有二氧化碳和水蒸气。
(提出猜想)同学们发现残留固体呈白色,对该固体成分进行猜想:
猜想Ⅰ:固体成分是![]() ,
,![]() 参加反应。
参加反应。
猜想Ⅱ:固体成分是![]() ,
,![]() 参加反应。
参加反应。
猜想Ⅲ:固体成是______________________________,![]() 和
和![]() 均参加反应。
均参加反应。
(实验探究)同学们取白色固体于试管中配成溶液,设计实验对猜想进行验证。
验证Ⅰ:向溶液中滴加稀盐酸,发现有气泡产生。有同学认为固体成分仅含有![]() 。
。
验证Ⅱ:蘸取少量溶液滴到pH试纸上,与标准与色卡比较,pH大于7。有同学认为固体是![]() ,请问此结论是否正确?原因是:____________________。
,请问此结论是否正确?原因是:____________________。
验证Ⅲ:请你设计实验验证猜想Ⅲ。
步骤 | 现象 | 结论 |
①___________; ②__________。 | ①有白色沉淀到生成; ②__________________。 | 猜想Ⅲ是正确的 |
(实验反思)由验证Ⅲ的结果可知,验证Ⅰ的结论错误,因为它不能排除____________________的存在。