题目内容
(6分)某同学在查阅资料时得知:市售纯碱样品常混有氯化钠杂质。
该同学设计了如下图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数。(水蒸气的影响忽略不计,夹持装置已略去)
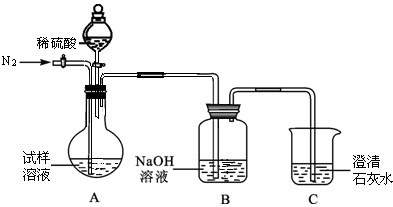
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5 g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2 g。
请回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)鼓入一定量的N2的目的是 。装置C中澄清石灰水的作用是 。
(3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) 。
(4)该样品中碳酸钠的质量分数为 %(结果保留到小数点后一位)。
(5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 。

该同学设计了如下图中的装置进行实验,测定市售纯碱样品中碳酸钠的质量分数。(水蒸气的影响忽略不计,夹持装置已略去)

主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②称量5.5 g市售纯碱样品放入烧瓶中,加适量蒸馏水溶解,得到试样溶液;
③从分液漏斗滴入稀硫酸,直到不再产生气体时为止;
④缓缓鼓入一定量的N2;
⑤称量B瓶及溶液的质量,发现增重2.2 g。
请回答下列问题:
(1)写出A中发生反应的化学方程式 。
(2)鼓入一定量的N2的目的是 。装置C中澄清石灰水的作用是 。
(3)如果将分液漏斗中的稀硫酸换成浓盐酸,测试的结果(填偏高、偏低或不变) 。
(4)该样品中碳酸钠的质量分数为 %(结果保留到小数点后一位)。
(5)若用与上述实验反应原理不同的实验来测定纯碱样品中碳酸钠的质量分数,请用化学方程式表示实验原理 。
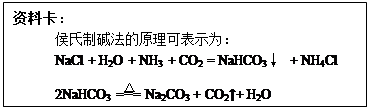
(1)Na2CO3 + H2SO4 Na2SO4 + H2O + CO2↑。
(2)排出装置A及导管中残留CO2,使其全部被装置B中NaOH溶液吸收;
检验CO2是否被B瓶中的NaOH溶液完全吸收
(3)偏高
(4)96.4%
(5)Na2CO3 + CaCl2 CaCO3↓+ 2NaCl(或与BaCl2、Ba(OH)2反应)
(2)排出装置A及导管中残留CO2,使其全部被装置B中NaOH溶液吸收;
检验CO2是否被B瓶中的NaOH溶液完全吸收
(3)偏高
(4)96.4%
(5)Na2CO3 + CaCl2 CaCO3↓+ 2NaCl(或与BaCl2、Ba(OH)2反应)
试题分析:(1)样品中氯化钠不与硫酸反应,碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,故化学方程式为Na2CO3+H2SO4Na2SO4+H2O+CO2↑。
(2)为使残留在反应容器中生成的二氧化碳全部被氢氧化钠吸收,通入不能与氢氧化钠发生反应的氮气排出反应装置内的二氧化碳;装置C中盛放澄清石灰水检验二氧化碳气体是否全部被氢氧化钠吸收;
(3)稀硫酸不挥发而浓盐酸具有很强的挥发性,挥发出的HCl气体被氢氧化钠溶液吸收后,导致测得二氧化碳的质量偏高;
(4)氢氧化钠增重2.2g,说明反应放出2.2g二氧化碳,
设反应消耗碳酸钠的质量为x
Na2CO3+H2SO4Na2SO4+H2O+CO2↑
106 44
x 2.2g
106:44= x:2.2g
解得,x=5.3g
该样品中碳酸钠的质量分数=
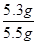 ×100%=96.4%
×100%=96.4%(5)碳酸钠能与氯化钙(或BaCl2)等反应生成碳酸钙沉淀,因此可选用氯化钙溶液与碳酸钠反应,通过测定生成沉淀或加入氯化钙的质量测定样品中碳酸钠的质量,而得到样品中碳酸钠的质量分数;故碳酸钠与氯化钙反应的化学方程式为Na2CO3+CaCl2CaCO3↓+2NaCl
点评:本题主要考查学生利用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力。

练习册系列答案
相关题目

 2HCl)
2HCl)