题目内容
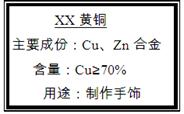
(10分)小强买来一包黄铜(铜、锌合金),包装说明如右图,他对包装说明上的质量分数产生了疑问,他称取20g黄铜样品放入烧杯中,然后往烧杯中加入稀硫酸93.7g,恰好完全反应,反应后称得烧杯内物质共113.5g。
(1)反应产生氢气 g。
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同)。
(3)计算反应后所得溶液中溶质的质量分数是多少?

(1)反应产生氢气 g。
(2)通过计算判断该黄铜样品中铜的质量分数是否与包装说明相符(计算结果精确到0.1%,下同)。
(3)计算反应后所得溶液中溶质的质量分数是多少?
(1) 0.2 (2)因为67.5%<70%,所以与包装说明不相符 (3)16.1%
试题分析:1、由于黄铜中只有锌与稀硫酸反应放出氢气,因此反应前后烧杯内物质总质量减小的部分即为产生氢气的质量,因此反应产生的氢气质量为:20+93.7-113.5=0.2克;
2、要计算黄铜的质量分数,先得计算出铜的质量。我们先可以根据氢气的质量计算出锌的质量,再用黄铜总质量减去锌的质量,即可得出铜的质量。而第(3)小题中要计算的溶质质量分数,就是反应生成的硫酸锌的质量分数,可以根据化学方程式计算硫酸锌的质量,再用硫酸锌的质量除以总溶液的质量即可。
解:设Zn质量为x, ZnSO4质量为y
Zn +H 2SO4 = ZnSO4 + H2↑ …………1分
65 161 2
x y 0.2g …………1分
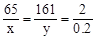 …………1分
…………1分
x=6.5g y=16.1g …………1分
该黄铜样品中Cu质量分数= ×100%=67.5% …………1分
×100%=67.5% …………1分
因为67.5%<70%,所以与包装说明不相符 …………1分
反应后溶质质量分数=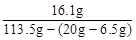 ×100%=16.1% …………2分
×100%=16.1% …………2分
答:略
点评:本题解题关键在于找出氢气的质量。
2、要计算黄铜的质量分数,先得计算出铜的质量。我们先可以根据氢气的质量计算出锌的质量,再用黄铜总质量减去锌的质量,即可得出铜的质量。而第(3)小题中要计算的溶质质量分数,就是反应生成的硫酸锌的质量分数,可以根据化学方程式计算硫酸锌的质量,再用硫酸锌的质量除以总溶液的质量即可。
解:设Zn质量为x, ZnSO4质量为y
Zn +H 2SO4 = ZnSO4 + H2↑ …………1分
65 161 2
x y 0.2g …………1分
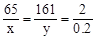 …………1分
…………1分x=6.5g y=16.1g …………1分
该黄铜样品中Cu质量分数=
 ×100%=67.5% …………1分
×100%=67.5% …………1分因为67.5%<70%,所以与包装说明不相符 …………1分
反应后溶质质量分数=
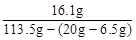 ×100%=16.1% …………2分
×100%=16.1% …………2分答:略
点评:本题解题关键在于找出氢气的质量。

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目

 +H2↑ 。
+H2↑ 。