题目内容
【题目】黄铜渣中约含![]() 7%、
7%、![]() 31%、
31%、![]() 50%、
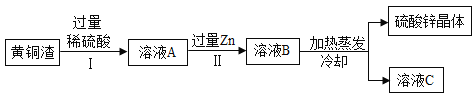
50%、![]() 5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如图所示(杂质不溶于水、不参与反应)。
5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如图所示(杂质不溶于水、不参与反应)。
已知:![]() ;
;![]()
①Ⅱ中反应的化学方程式为________。
②下列说法正确的是________。
a Ⅰ、Ⅱ中的操作均包含过滤 b 溶液A中![]() 的质量大于
的质量大于![]()
c 溶液A的质量小于溶液B d 溶液C中溶质的质量分数小于溶液B
【答案】![]()
![]() a,b,c
a,b,c
【解析】
(1)由题头我们可以得出信息:黄铜渣中有效的物质为![]() ,处理后我们要得到硫酸锌。而且杂质不溶于水、不参与反应,即反应过程中不用考虑杂质,把它过滤出去即可。
,处理后我们要得到硫酸锌。而且杂质不溶于水、不参与反应,即反应过程中不用考虑杂质,把它过滤出去即可。
(2)分析流程中的每一步骤:
第一步:反应物为![]() 和过量的稀硫酸。
和过量的稀硫酸。
发生的反应为![]() ;
;![]() ;
;![]() ;
;![]() ;该反应使
;该反应使![]() 溶于稀硫酸,但是杂质和铜没有反应还是以固体形式存在,过滤就可使固液分离,滤出的固体为杂质和铜。由于单质锌含量不多,溶液中又有大量的硫酸,所以溶液A中还有硫酸铜。最后溶液A为:硫酸锌、硫酸铜和硫酸(注意加入的是过量稀硫酸)。
溶于稀硫酸,但是杂质和铜没有反应还是以固体形式存在,过滤就可使固液分离,滤出的固体为杂质和铜。由于单质锌含量不多,溶液中又有大量的硫酸,所以溶液A中还有硫酸铜。最后溶液A为:硫酸锌、硫酸铜和硫酸(注意加入的是过量稀硫酸)。
第二步:反应物溶液A为硫酸锌、硫酸铜和硫酸。
发生的反应为![]() ;
;![]() ;该反应利用锌比铜活泼,锌把铜从溶液中置换出来。又形成了固液混合物,过滤就可使固液分离,滤出的固体为过量的锌和铜,溶液B为硫酸锌。
;该反应利用锌比铜活泼,锌把铜从溶液中置换出来。又形成了固液混合物,过滤就可使固液分离,滤出的固体为过量的锌和铜,溶液B为硫酸锌。
第三步:最后把硫酸锌溶液加热蒸发、冷却即可得到硫酸锌晶体。当然还有一部分硫酸锌溶解在水中,就形成了溶液C,但是我们分离的是硫酸锌晶体和硫酸锌溶液,所以溶液C肯定是硫酸锌的饱和溶液。
①由于锌排在氢和铜的前面,锌既可以与酸反应,也可以与硫酸铜反应,反应的化学方程式分别为![]() ;
;![]() 。②由图可知,操作Ⅰ过滤后得铜和固体杂质,操作Ⅱ过滤是除去过量的锌和铜;因氧化锌的质量大于氧化铜,故溶液A中硫酸锌的质量大于硫酸铜;溶液A加入锌后,反应的化学方程式分别为
。②由图可知,操作Ⅰ过滤后得铜和固体杂质,操作Ⅱ过滤是除去过量的锌和铜;因氧化锌的质量大于氧化铜,故溶液A中硫酸锌的质量大于硫酸铜;溶液A加入锌后,反应的化学方程式分别为![]() ;
;![]() ;对于反应
;对于反应![]() 分析可知,每65份质量的锌进入溶液,从溶液中出来2份质量的氢气,使得溶液质量增加,对于反应
分析可知,每65份质量的锌进入溶液,从溶液中出来2份质量的氢气,使得溶液质量增加,对于反应![]() 来说,每65份质量的锌进入溶液,从溶液中析出64份质量的铜,也使得溶液质量增大;故溶液A的质量小于溶液B;溶液C为饱和溶液,质量分数达到同温度下的最大值。
来说,每65份质量的锌进入溶液,从溶液中析出64份质量的铜,也使得溶液质量增大;故溶液A的质量小于溶液B;溶液C为饱和溶液,质量分数达到同温度下的最大值。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案