题目内容
【题目】金属及金属材料在生产、生活中有广泛的应用。
(1)近年来,我市开展文明城市创建工作,垃圾分类回收是其中一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:
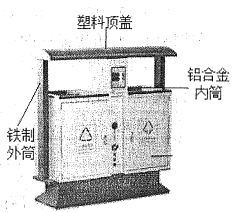
①图中标识的物质,属于金属材料的是_______________ (写出一种即可)。
②某品牌饮料的空易拉罐应收入_______________(填 “可回收”或“不可回收”)筒中。
③铁制品锈蚀的过程,实际上是铁跟空气中的_____________发生化学反应的过程。
(2)将甲、乙、两三种金属分别投入稀硫酸中,甲、丙表面有气泡产生。乙无明显现象;若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顾序是_______________。
(3)将一定质量的铁粉加入到Al(NO3)3、 Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是__________(填字母)。
A 若滤液为蓝色,则滤渣中一定有银,可能有铜
B 若滤渣中含有银、铜、铁,则滤液中一定含有A13+、Fe3+、 NO3-
C 若滤液为浅绿色,则滤渣中一定含银、铜、铝
D 若滤渣中加稀盐酸无气泡产生,则溶液中一定有A13+、Fe3+、Cu2+,可能有Ag+
(4)用一氧化碳治炼2000t含杂质3%的生铁。需要含四氧化三铁90%的磁铁矿的质量是__________t结果精确到 0.1。
(5)某金属粉末可能由镁、锌、铁、铝、银中的一种或几种组成。取该样品2.4g,向其中加入100g 一定溶质量分数的稀硫酸,恰好完全反应生成0.2g 氢气,得到无色溶液,固体无剩余。下列说法正确的是____ (填序号)。
A 样品中一定含有镁
B 样品中一定不含有银,可能含有镁
C 所得溶液中溶质总质量为12g
D 加入的稀硫酸的溶质质量分数为19.6%
【答案】铁制外筒、铝合金内筒 可回收 水和氧气 甲>丙>乙 A 2976.7t BC
【解析】
金属材料包括纯金属和合金,金属生锈是金属和水和氧气共同作用的结果,铁和硝酸银反应生成银和硝酸亚铁,铁和硝酸铜反应生成硝酸亚铁和铜,镁和稀硫酸反应生成硫酸镁和氢气,锌和稀硫酸反应生成硫酸锌和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气,铝和稀硫酸反应生成硫酸铝和氢气。
(1)①金属材料包括纯金属和合金,故图中标识的物质,属于金属材料的是铁制外筒、铝合金内筒。
②空易拉罐属于可回收垃圾,故某品牌饮料的空易拉罐应收入可回收筒中。
③金属生锈是金属和水和氧气共同作用的结果,故铁制品锈蚀的过程,实际上是铁跟空气中的水和氧气发生化学反应的过程。
(2)将甲、乙、两三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象,说明甲、丙的金属活动性强于乙,若将甲放入丙的硫酸盐溶液中,一段时间后,甲的表面有丙析出,说明甲的金属活动性强于丙,故这三种金属的活动性由强到弱的顾序是甲>丙>乙。
(3)A、由金属活动性顺序表可知,铁、铝、铜、银四种金属活动性顺序为铝>铁>铜>银,将一定质量的铁粉加入到Al(NO3)3、 Cu(NO3)2、AgNO3三种物质的混合溶液中,铁和硝酸银先反应生成硝酸亚铁和银,然后铁和硝酸铜反应生成硝酸亚铁和铜,若滤液为蓝色,说明含有硝酸铜,硝酸银反应完全,则滤渣中一定有银,可能有铜,故A正确;
B、将一定质量的铁粉加入到Al(NO3)3、 Cu(NO3)2、AgNO3三种物质的混合溶液中,铁和硝酸银先反应生成硝酸亚铁和银,然后铁和硝酸铜反应生成硝酸亚铁和铜,若滤渣中含有银、铜、铁,说明硝酸银和硝酸铜反应完全,则滤液中一定含有A13+、Fe2+、 NO3-,故B不正确;
C、铁先和硝酸银反应生成硝酸亚铁和银,然后铁和硝酸铜反应生成硝酸亚铁和铜,若滤液为浅绿色,铁和硝酸铝不反应,滤渣中一定不含铝,故C不正确;
D、铁先和硝酸银反应生成硝酸亚铁和银,然后铁和硝酸铜反应生成硝酸亚铁和铜,若滤渣中加稀盐酸无气泡产生,说明铁反应完全,则溶液中一定有A13+、Fe2+,可能有Cu2+和Ag+,故D不正确。故选A。
(4)设需要含四氧化三铁90%的磁铁矿的质量是x

![]()
![]()
故需要含四氧化三铁90%的磁铁矿的质量是2976.7t。
(5)A、镁、锌、铁、铝和稀硫酸反应的关系式为![]() ,
,![]() ,
,![]() ,
,![]() ,2.4镁和稀硫酸完全反应生成0.2g氢气,2.4g铝和稀硫酸反应生成氢气的质量大于0.2g,2.4g锌和稀硫酸反应生成氢气的量小于0.2g,2.4g铁和稀硫酸反应生成氢气的量小于0.2g,则金属可能是镁,故A不正确;
,2.4镁和稀硫酸完全反应生成0.2g氢气,2.4g铝和稀硫酸反应生成氢气的质量大于0.2g,2.4g锌和稀硫酸反应生成氢气的量小于0.2g,2.4g铁和稀硫酸反应生成氢气的量小于0.2g,则金属可能是镁,故A不正确;
B、向其中加入100g 一定溶质量分数的稀硫酸,恰好完全反应,得到无色溶液,固体无剩余,样品中一定不含有银,2.4镁和稀硫酸完全反应生成0.2g氢气,可能含有镁,故B正确;
C、反应生成0.2g氢气,氢元素全部来自硫酸,参加反应的硫酸的质量![]() ,所得溶液中溶质总质量为
,所得溶液中溶质总质量为![]() ,故C正确;
,故C正确;
D、参加反应的硫酸的质量![]() ,加入的稀硫酸的溶质质量分数为
,加入的稀硫酸的溶质质量分数为![]() ,故D不正确。故选BC。
,故D不正确。故选BC。

 口算能手系列答案
口算能手系列答案【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 10 | m |
第2次 | 10 | 7.4 |
第3次 | 10 | 6.1 |
第4次 | 10 | 5.6 |
第5次 | 10 | 5.6 |
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6g固体的成分是 ;表格中,m= .
(2)黄铜样品中锌的质量分数为 .
(3)计算所用稀硫酸中硫酸的质量分数是多少?