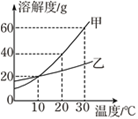
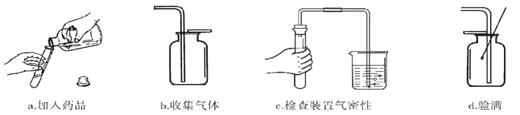
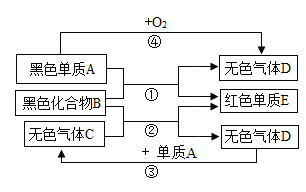
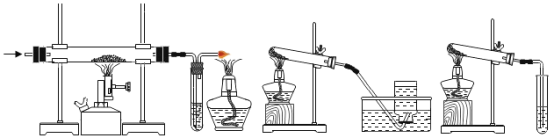
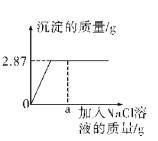
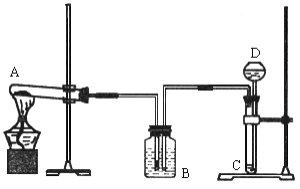
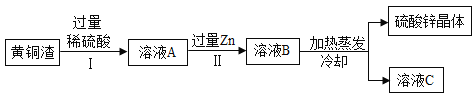
题目内容
【题目】(1)早在西汉时期的《淮南万毕术》中就记载“曾青(硫酸铜溶液)得铁则化为铜”,成为现代湿法冶金的先驱,请写出该反应的化学方程式____________;
(2)“千锤百炼出深山”出自明朝于谦的《石灰吟》,诗句表达了石灰石高温分解的过程,请你写出该反应的化学方程式________。
【答案】Fe+CuSO4═Cu+FeSO4 CaCO3![]() CaO+CO2↑
CaO+CO2↑
【解析】
(1)曾青(硫酸铜溶液)得铁则化为铜,铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为Fe+CuSO4═Cu+FeSO4,故填:Fe+CuSO4═Cu+FeSO4。
(2)石灰石高温分解生成氧化钙和二氧化碳,化学方程式为CaCO3![]() CaO+CO2↑,故填:CaCO3
CaO+CO2↑,故填:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。

 阅读快车系列答案
阅读快车系列答案【题目】小明同学在实验结束进行废液处理,将氢氧化钠、石灰水和稀盐酸倒入同一洁净的烧杯中,当他用手接触烧杯外壁时,感觉到“发热”,这一现象引起了他的注意,于是他进行了如下探究。
[提出问题]这三种物质混合后,溶液中溶质的组成有几种可能?这三种物质间发生反应的一个化学方程式为_____。你认为发热的原因是______。
[提出假设]小明对反应后溶液中溶质的组成作出了两种合理的假设。
假设①:溶质为NaCl、CaCl2
假设②:溶质为NaCl、CaCl2、 NaOH、 Ca(OH)2
假设③:溶质为NaCl、CaCl2、NaOH
请你再补充一种合理的假设
假设④:溶质为________。
[实验验证]如果假设④成立,请你设计一个实验方案进行验证。
实验步骤及操作方法 | 实验现象 | 实验结论 |
____ | ____ | 假设④成立 |
[实验反思] (1)比较几种假设,能说明作出假设④的理由是__。
(2)在分析化学反应后所得物质的成分时,除考虑生成物外还需考虑_____。
【题目】Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件.某化学兴趣小组的同学为了测定某黄铜的组成,取10g该黄铜样品于烧杯中,向其中分5次加入相同溶质质量分数的稀硫酸,使之充分反应.每次所用稀硫酸的质量及剩余固体的质量记录于下表:
加入稀硫酸的质量(g) | 充分反应后剩余固体的质量(g) | |
第1次 | 10 | m |
第2次 | 10 | 7.4 |
第3次 | 10 | 6.1 |
第4次 | 10 | 5.6 |
第5次 | 10 | 5.6 |
试回答下列问题:
(1)从以上数据可知,最后剩余的5.6g固体的成分是 ;表格中,m= .
(2)黄铜样品中锌的质量分数为 .
(3)计算所用稀硫酸中硫酸的质量分数是多少?