题目内容
【题目】碳酸钠和碳酸氢钠是生活中常见的盐,课外小组通过以下实验进行鉴别。
[实验1]通过溶液的酸碱度进行鉴别。
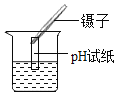
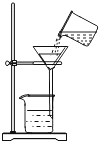
分别取两种固体各 1 g 加水溶解,再测其溶液的 pH,如图所示,实验测得:碳酸钠溶液的 pH 为11.96;碳酸氢钠溶液的 pH 为 8.28。
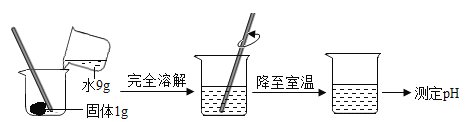
(1)从本实验的操作中,控制的变量是_____和________。
(2)由实验得出的结论是____。
[实验2]通过与盐酸反应产生CO2气体速率进行鉴别。
将碳酸钠和碳酸氢钠分别配制成 2﹪的溶液,取等量的两溶液分别于三颈烧瓶中,滴加等量的稀盐酸,通过传感器测得CO2的浓度(如下图所示)。

(3)写出碳酸钠或碳酸氢钠与稀盐酸反应的化学方程式:_____。
(4)实验中要获得可靠的数据,必须要控制的条件是____。
(5)通过计算分析,碳酸钠与稀盐酸反应对应的是曲线_____(填“甲”或“乙”)。
[实验3] 通过固体的热稳定性进行鉴别。
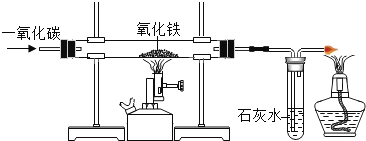
(6)试管内的固体分别取等质量碳酸钠和碳酸氢钠于试管中进行加热(如图所示)。资料:![]() 。
。
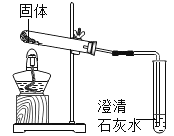
实验中澄清石灰未变浑浊,则试管内加入的固体是______。
(7)完全分解8.4 g NaHCO3,试管内物质的质量减少____g。
【答案】温度 溶质的质量分数 在相同条件下,碳酸钠溶液的碱性比碳酸氢钠的碱性强 ![]() 或
或 ![]() 注射器加入稀盐酸的速度相同 乙 碳酸钠 3.1
注射器加入稀盐酸的速度相同 乙 碳酸钠 3.1
【解析】
(1)分别取两种固体各 1 g 加9g水溶解,由于两者固体物质的溶解度不同,所以得到的两者溶液的溶质质量分数不同,即变量一是溶质的质量分数,故填溶质的质量分数;
然后降低温度,由于两种物质的溶解度不同,降温后影响了溶液的溶质质量分数,进而影响了溶液的pH,即变量二是温度,故填温度。
(2)由图可知,实验测得碳酸钠溶液的 pH 为11.96,碳酸氢钠溶液的 pH 为 8.28,两种溶液均呈碱性,对于碱性溶液来说,碱性越强,溶液的pH越大,所以由实验测得的结果可知,在相同条件下,碳酸钠溶液的碱性比碳酸氢钠的碱性强,故填在相同条件下,碳酸钠溶液的碱性比碳酸氢钠的碱性强。
(3)碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,碳酸氢钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式是:NaHCO3+HCl=NaCl+H2O+CO2↑,故填Na2CO3+2HCl=2NaCl+H2O+CO2↑或NaHCO3+HCl=NaCl+H2O+CO2↑。
(4)向两种溶液中滴加等量的稀盐酸,通过传感器测得生成CO2的浓度,用注射器向两种溶液中加入稀盐酸的速度应该相同,才能保证参加反应的盐酸质量相同,从而准确测出二氧化碳的浓度,故填注射器加入稀盐酸的速度相同。
(5)由碳酸钠与稀盐酸反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑可知参加反应的盐酸与生成的二氧化碳的质量比=73:44,由碳酸氢钠与稀盐酸反应的化学方程式是:NaHCO3+HCl=NaCl+H2O+CO2↑可知,参加反应的盐酸与生成的二氧化碳的质量比=73:88,所以两种物质与等质量盐酸反应时,碳酸氢钠生成的二氧化碳的质量大于碳酸钠生成的二氧化碳的质量,所以碳酸钠与稀盐酸反应对应的曲线是乙,故填乙。
(6)碳酸钠受热不发生反应,不会生成二氧化碳,石灰水不变浑浊,而碳酸氢钠受热反应生成二氧化碳能使澄清石灰水变浑浊,所以试管内加入的固体是碳酸钠,故填碳酸钠。
(7)解:设生成碳酸钠的质量为x
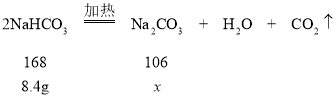
168:106=8.4g: x
x=5.3g
试管内物质减少的质量=8.4g5.3g=3.1g
答:试管内物质减少的质量为3.1g。

【题目】宏微相结合是认识物质结构的有效方法之一。
(1)已知:X、Y、X、W 四种粒子的核电荷数及核外各电子排布情况如下表:
粒子 | X | Y | Z | W | |
对应元素名称 | 氧 | 镁 | 铝 | 氯 | |
核电荷数 | 8 | 12 | 13 | 17 | |
电子层 | 第一层 | 2 | 2 | 2 | 2 |
第二层 | a | 8 | 8 | 8 | |
第三层 | 3 | 8 | |||
请回答下列问题:
①若 X 表示原子,a= ___。单质X2与单质 Z 的反应中,X 原子____(填“得到”或“失 去”)电子。
②Y、W 形成的化合物化学式为____(用元素符号表示)。
(2)甲和乙可以合成清洁燃料丙,微观过程如图所示。回答下列问题:
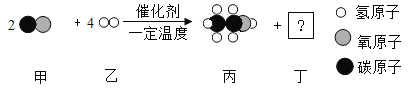
①丁物质的1个分子中由____________个原子构成。
②丙中C、H、O的质量比为____________。
③写出丙物质作燃料的化学方程式____________。