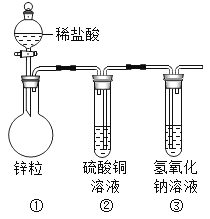
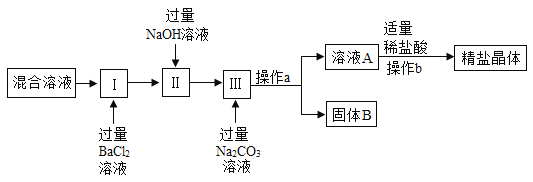
题目内容
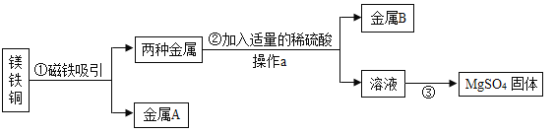
【题目】过一硫酸氢钠复合盐(Na2SO4·NaHSO4·2NaHSO5)是一种新型酸性过氧化物消毒剂。以过氧化氢溶液、浓硫酸、碳酸钠为原料制备过一硫酸氢钠复合盐的一种工艺流程如下:
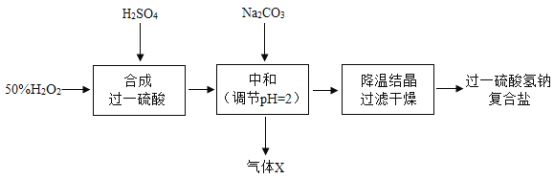
注:过一硫酸(H2SO5)在常温下为无色晶体,熔点 45℃,易溶于硫酸溶液中,可与水缓慢反应生成硫酸与过氧化氢,受热易分解。
(1)碳酸钠的俗名为________。过一硫酸氢钠复合盐中共含有_________种元素。
(2)中和过程中有如下反应发生:Na2CO3 + H2SO4 = Na2SO4 + X↑+ H2O。气体 X的化学式为_________。
(3)在合成过一硫酸时,反应温度应控制在-4℃左右的主要原因是_____。
(4)固定H2O2的用量,以H2O2与H2SO4的质量比、中和温度及所加 Na2CO3 的质量为变量,可探究上述三种因素对复合盐产量的影响(见下表)。
实验序号 | H2O2 与 H2SO4 质量比 | 中和温度/℃ | Na2CO3 用量/g |
① | 47.6 : 29.8 | 7 | 23.0 |
② | 47.6 : 33.6 | 10 | 25.0 |
③ | 47.6 : 25.3 | 4 | 21.5 |
④ | 47.6 : 29.8 | 10 | 23.0 |
⑤ | 47.6 : 25.3 | 7 | 21.5 |
上述实验中,可用来探究中和温度对复合盐产量影响的是__________(填字母)。
a 实验①、④ b 实验②、③ c 实验③、④ d 实验③、⑤
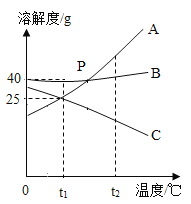
(5)在双氧水定量的基础上,所用硫酸溶液中溶质的质量分数与复合盐中活性氧含量的关系见下图。
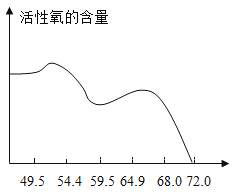
①验过程中选用质量分数为55%左右的硫酸溶液,主要原因是_______。
②配制 98g 质量分数为55.2%的硫酸溶液所需质量分数为 98%的硫酸溶液(密度约为1.84g/cm3)的体积为_______mL。
【答案】纯碱或苏打 四 CO2 防止过一硫酸受热分解 a、d 在此时活性氧含量最高 30
【解析】
(1)碳酸钠俗称纯碱或苏打;过一硫酸氢钠复合盐中一共含有Na、S、O、H四种元素;故填:纯碱或苏打;四。
(2)根据质量守恒定律可知化学反应前后原子种类、数目不变,反应前有钠原子2个,碳原子1个,氧原子7个,氢原子2个,硫原子1个,反应后钠原子2个,氧原子5个,氢原子2个,硫原子1个,缺了1个碳原子和2个氧原子,故X是CO2。故填:CO2。
(3)因为过一硫酸(H2SO5)熔点低且受热易分解,而浓硫酸入水会放出大量热,反应过程中也有热量放出,所以反应温度应控制在-4℃左右。故填:防止过一硫酸受热分解。
(4)要探究中和温度对复合盐产量影响,那么必须保证H2O2与H2SO4的质量比、所加 Na2CO3 的质量这俩是相同的,中和温度是不同的,根据表中数据可知实验①、④或实验③、⑤都满足,故填:a、d。
(5)①由图像可知在双氧水定量的基础上硫酸溶液在质量分数为55%左右时活性氧含量最高,所以才选用此时的质量分数。故填:在此时活性氧含量最高。
②设配制98g质量分数为55.2%的稀硫酸,需要质量分数为98%的浓硫酸的体积为x。根据溶液稀释前后溶质的质量不变得:98g×55.2%=1.84g/cm3×x×98%,得x=30ml。故填:30。