题目内容
【题目】请回答下列与金属有关的问题。
(1)生铁片与纯铁片相互刻画时,在_____片表面会留下划痕。
(2)为了防止月饼变质,常在月饼的内包装袋中放入一小包防腐剂,它的主要成分是铁粉,铁粉的作用是_____。
(3)向AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,充分反应后过滤,向滤渣中加盐酸有气泡,则滤渣中一定含有的金属是_____。
(4)为了达到收旧利废的目的,欲从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,其主要实验过程如下,请回答:
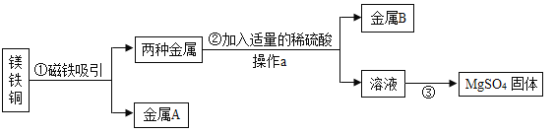
①步骤①中被磁铁吸引的金属A是_____。
②步骤③的操作是_____。
③步骤②所涉及的化学方程式为_____。
(5)将7.3g已部分氧化的锌粉,加入到98g10%的稀硫酸中,恰好完全反应。则所得溶液中溶质的质量为_____(填序号)。
A 14.5g B 5.5g C 16.1g D 18.1g
【答案】纯铁片 与氧气发生反应,防止月饼因氧化而变质并且能吸水防潮 Ag、Cu、Zn 铁(或Fe) 蒸发 Mg+H2SO4=MgSO4+H2↑ C
【解析】
(1)合金要比组成成分的金属的硬度大,生铁片与纯铁片相比,生铁片硬度大,纯铁硬度小,所以相互刻画时,在纯铁片表面会留下划痕。
(2)铁生锈需要与氧气和水接触,所以常在月饼的内包装袋中放入一小包防腐剂铁粉,铁粉的作用是与氧气发生反应,防止月饼因氧化而变质并且能吸水防潮;
(3)在金属活动性顺序中,锌>氢>铜>银,锌能与硝酸银反应生成银和硝酸锌,可以和硝酸铜反应生成铜和硝酸锌;所以放入锌后,锌要先置换出硝酸银中银,再去置换硝酸铜中的铜,所以如果向滤渣中加盐酸有气泡,则滤渣中一定含有锌,即加入的锌过量,所以银和铜都被置换出来了,所以滤渣中含有铜、锌、银;
(4)①铁能够被磁铁吸引,因此A是铁;镁和铜的混合物中,加入适量的稀硫酸,镁和硫酸反应生成硫酸镁和氢气,铜不反应,因此过滤可以得到B,即金属铜;
②硫酸镁溶液蒸发结晶即可得到硫酸镁固体;
③步骤②是镁和硫酸反应生成硫酸镁和氢气,其化学方程式为:Mg+H2SO4=MgSO4+H2↑
(5)解:设所得溶液中溶质的质量为x,由Zn+H2SO4═ZnSO4+H2↑、ZnO+H2SO4═ZnSO4+H2O 得:

根据:![]() 解得:x=16.1g
解得:x=16.1g
由以上计算可知,A、B、D错误,C正确
故答案为:(1)纯铁片(2)与氧气发生反应,防止月饼因氧化而变质并且能吸水防潮(3)Ag、Cu、Zn (4)铁(或Fe);过滤;Mg+H2SO4=MgSO4+H2↑(5)C。

【题目】过一硫酸氢钠复合盐(Na2SO4·NaHSO4·2NaHSO5)是一种新型酸性过氧化物消毒剂。以过氧化氢溶液、浓硫酸、碳酸钠为原料制备过一硫酸氢钠复合盐的一种工艺流程如下:
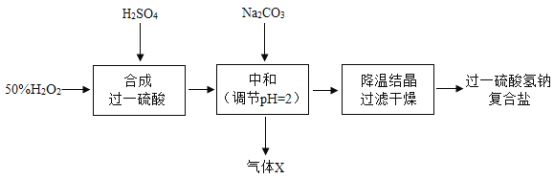
注:过一硫酸(H2SO5)在常温下为无色晶体,熔点 45℃,易溶于硫酸溶液中,可与水缓慢反应生成硫酸与过氧化氢,受热易分解。
(1)碳酸钠的俗名为________。过一硫酸氢钠复合盐中共含有_________种元素。
(2)中和过程中有如下反应发生:Na2CO3 + H2SO4 = Na2SO4 + X↑+ H2O。气体 X的化学式为_________。
(3)在合成过一硫酸时,反应温度应控制在-4℃左右的主要原因是_____。
(4)固定H2O2的用量,以H2O2与H2SO4的质量比、中和温度及所加 Na2CO3 的质量为变量,可探究上述三种因素对复合盐产量的影响(见下表)。
实验序号 | H2O2 与 H2SO4 质量比 | 中和温度/℃ | Na2CO3 用量/g |
① | 47.6 : 29.8 | 7 | 23.0 |
② | 47.6 : 33.6 | 10 | 25.0 |
③ | 47.6 : 25.3 | 4 | 21.5 |
④ | 47.6 : 29.8 | 10 | 23.0 |
⑤ | 47.6 : 25.3 | 7 | 21.5 |
上述实验中,可用来探究中和温度对复合盐产量影响的是__________(填字母)。
a 实验①、④ b 实验②、③ c 实验③、④ d 实验③、⑤
(5)在双氧水定量的基础上,所用硫酸溶液中溶质的质量分数与复合盐中活性氧含量的关系见下图。
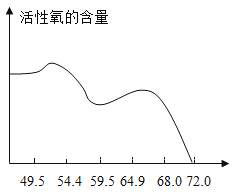
①验过程中选用质量分数为55%左右的硫酸溶液,主要原因是_______。
②配制 98g 质量分数为55.2%的硫酸溶液所需质量分数为 98%的硫酸溶液(密度约为1.84g/cm3)的体积为_______mL。