��Ŀ����
����Ŀ���ᡢ����Ǽ�����Ҫ�Ļ����
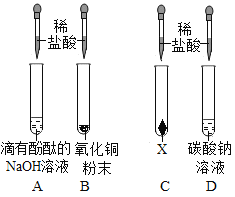
��1����ʢ��Ũ�����Ũ������Լ�ƿ�ǣ��������ܰ��������ֿ�����ԭ����_____��
��2��100 g��������Ϊ10%��ϡ�����100 g��������Ϊ10%������������Һ��ַ�Ӧ����Һ��pH_____7��������������С������������������
��3����������ʵ��װ�����ľ����У�ij��ѧ��ȤС���ͬѧ�������ͼ��ʾ��װ�á�
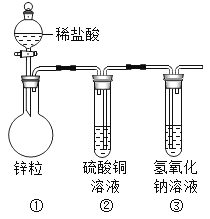
��д��װ�ü��з�����Ӧ�Ļ�ѧ����ʽ_____��
�ڱ�װ���л����ʲô����_____��
��4��ijͬѧΪ�˳�ȥNaCl��Һ��CaCl2��MgCl2��Na2SO4������ȡ���Σ�����������ͼ��ʾ��[��ʾ��Mg(OH)2��BaSO4��BaCO3������ˮ]
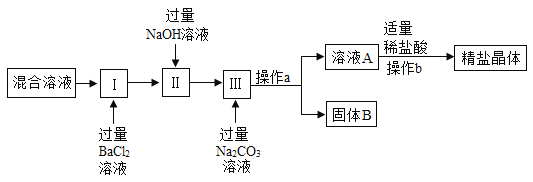
��д����I���м������BaCl2��Һ��������Ӧ�Ļ�ѧ����ʽ_____��
�ڲ���a������Ϊ_____��
��ͨ������a������ҺA�г��Ȼ����⣬�����е���������Щ_____��
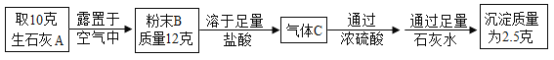
��5����20 g�����Ȼ������ʵ�̼���ƹ����м���100 gϡ���ᣬǡ����ȫ��Ӧ���õ�115.6g��������Һ��������ϡ�����������������_____��
���𰸡�ƿ�ڳ��ְ�������Ũ���ᣬ��ΪŨ�����лӷ��� ���� Zn+H2SO4=ZnSO4+H2�� ����ɫ�������ɣ���Һ����ɫ�����ɫ BaCl2+Na2SO4�TBaSO4��+2NaCl ���� �������ƺ�̼���� 7.3%
��������
��1��������������Ȼ�����лӷ��ԣ��Ȼ������ˮ�����γ�����СҺ�Σ�����������������ᣬ�����лӷ��ԣ���ʢŨ�����Ũ�����Լ�ƿ��ƿ�ǣ��������ܰ��������ֿ�����ԭ���ǣ�ƿ�ڳ��ְ�������Ũ���ᣬ��ΪŨ�����лӷ��ԣ����ƿ�ڳ��ְ�������Ũ���ᣬ��ΪŨ�����лӷ��ԡ�
��2��100 g��������Ϊ10%��ϡ�����100 g��������Ϊ10%������������Һ�����ʵ�������Ϊ100g��10%=10g�����ݷ���ʽ��
![]()
��֪���������ƹ�������Ӧ����Һ�Լ��ԣ�pH����7,��������ڡ�
��3����п��ϡ���ᷴӦ����������������п����ƽ���ɣ����Zn+H2SO4=ZnSO4+H2����
�ڼ�������������ʹ�����е�����ͭ��Һ��ѹ����У�����ͭ���������Ʒ�Ӧ����������ͭ����������������ɫ�������ɣ���Һ����ɫ�����ɫ���������ɫ�������ɣ���Һ����ɫ�����ɫ��
��4���ټ������BaCl2��Һʱ���Ȼ�������������Һ��Ӧ�������ᱵ�������Ȼ��ƣ���Ӧ�Ļ�ѧ����ʽΪ��BaCl2+Na2SO4�TBaSO4��+2NaCl�����BaCl2+Na2SO4�TBaSO4��+2NaCl��
�ڲ���a������Ϊ���ˣ�������ˡ�
������������ϡ����ǰ����Һ���Ȼ��ơ��������������ƺ�̼���ƵĻ����Һ���������������Ȼ��ơ��������ƺ�̼���ƣ�����������ƺ�̼���ơ�
��5�����ɶ�����̼������Ϊ100g+20g-115.6g=4.4g��
������ϡ�����������������Ϊx��
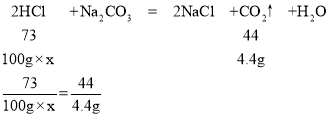
x=7.3%
������ϡ�����������������Ϊ7.3%��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����һ�������Ƹ����Σ�Na2SO4��NaHSO4��2NaHSO5����һ���������Թ����������������Թ���������Һ��Ũ���ᡢ̼����Ϊԭ���Ʊ���һ�������Ƹ����ε�һ�ֹ����������£�
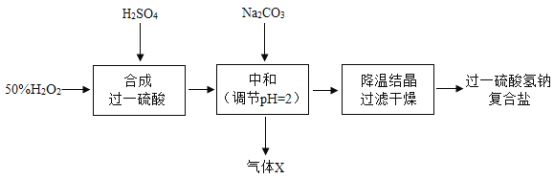
ע����һ���ᣨH2SO5���ڳ�����Ϊ��ɫ���壬�۵� 45����������������Һ�У�����ˮ������Ӧ����������������⣬�����ֽ⡣
��1��̼���Ƶ�����Ϊ________����һ�������Ƹ������й�����_________��Ԫ�ء�
��2���к����������·�Ӧ������Na2CO3 + H2SO4 = Na2SO4 + X��+ H2O������ X�Ļ�ѧʽΪ_________��
��3���ںϳɹ�һ����ʱ����Ӧ�¶�Ӧ������-4�����ҵ���Ҫԭ����_____��
��4���̶�H2O2����������H2O2��H2SO4�������ȡ��к��¶ȼ����� Na2CO3 ������Ϊ��������̽�������������ضԸ����β�����Ӱ�죨���±�����
ʵ����� | H2O2 �� H2SO4 ������ | �к��¶�/�� | Na2CO3 ����/g |
�� | 47.6 : 29.8 | 7 | 23.0 |
�� | 47.6 : 33.6 | 10 | 25.0 |
�� | 47.6 : 25.3 | 4 | 21.5 |
�� | 47.6 : 29.8 | 10 | 23.0 |
�� | 47.6 : 25.3 | 7 | 21.5 |
����ʵ���У�������̽���к��¶ȶԸ����β���Ӱ�����__________������ĸ����
a ʵ�������� b ʵ�������� c ʵ�������� d ʵ��������
��5����˫��ˮ�����Ļ����ϣ�����������Һ�����ʵ����������븴�����л����������Ĺ�ϵ����ͼ��
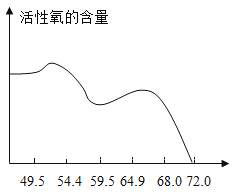
���������ѡ����������Ϊ55%���ҵ�������Һ����Ҫԭ����_______��
������ 98g ��������Ϊ55.2%��������Һ������������Ϊ 98%��������Һ���ܶ�ԼΪ1.84g/cm3�������Ϊ_______mL��