��Ŀ����
����Ŀ��������һ�ֱ�����Դ�������ÿ����з�����ĵ����ϳɰ������ϳɰ�����ᷢչ��������������˾��ף������Ǻϳɰ��Ĺ�������ͼ��
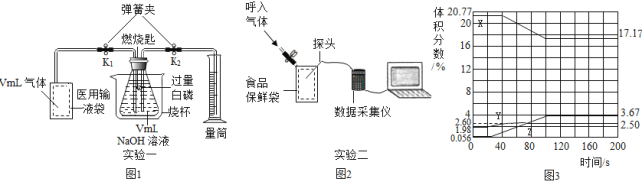
��1����������____���������������������е������������ԼΪ __%��
��2���û�ѧ�������
���������____ ���NH3�е�Ԫ�صĻ��ϼ�______
����__________ ����۵ķ�Ӧ��û�иı������__
��3�����е㲻ͬ��������뿪����������Һ�����뷨��������¶��ک�183��ʱ���ɽ�������N2��O2���롣�����±������ʵķе��жϣ�Ҫ������NH3��N2��H2���뿪�����¶�Ӧ�ÿ�����___�档
���� | H2 | N2 | O2 | NH3 |
�е� | ��252�� | ��195.8�� | ��183�� | ��33.35�� |
��4��ͼ��������Ģ٢ڢ۵ı仯�У��������������仯�Ĺ�����____����������ѭ��ʹ�õ�������___�������ƣ���
��5��д��N2��H2��Ӧ����NH3�Ļ�ѧ����ʽ_________��
���𰸡������ 78 2H2 ![]() He N��H -33.35 �� ���������� N����3H2
He N��H -33.35 �� ���������� N����3H2 ![]() 2NH3
2NH3
��������
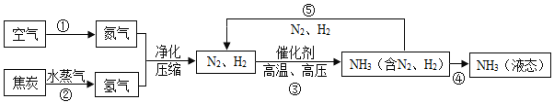
1���������ɵ�����������������̼����ɵĻ��������е������������ԼΪ78%��
��2�����ӵı�ʾ��������ȷ��д���ʵĻ�ѧʽ����ʾ����÷��ӣ����仯ѧʽǰ������Ӧ�����֣�������������ӱ�ʾΪ2H2����NH3����Ԫ�صĻ��ϼ�Ϊ+1�ۣ����ݻ�������Ԫ�صĻ��ϼ۴���Ϊ�㣬�ɵõ�Ԫ��Ϊ-3�ۣ�Ԫ�ػ��ϼ۵ı�ʾ������ȷ��������������Ҫ�����Ԫ�صĻ��ϼۣ�Ȼ�����仯ѧʽ��Ԫ�ص��Ϸ��������ź����ֱ�ʾ����������ǰ�������ں����Ա��NH3�е�Ԫ�صĻ��ϼ� ![]() �������ǵ�ԭ�ӷ��ӣ���Ԫ�ط��ſ���ֱ�ӱ�ʾ����ѧʽΪ��He�����ݹ������̿�֪������۵ķ�Ӧ�ǵ����������ڸ��¸�ѹ�����������������ɰ�����û�иı�����ǵ�ԭ�Ӻ���ԭ�ӣ�����Ϊ��N��H��
�������ǵ�ԭ�ӷ��ӣ���Ԫ�ط��ſ���ֱ�ӱ�ʾ����ѧʽΪ��He�����ݹ������̿�֪������۵ķ�Ӧ�ǵ����������ڸ��¸�ѹ�����������������ɰ�����û�иı�����ǵ�ԭ�Ӻ���ԭ�ӣ�����Ϊ��N��H��
��3�������¶��ک�183��ʱ���ɽ�������N2��O2���룬���Ҫ������NH3��N2��H2���뿪�����¶�Ӧ�ÿ����ک�33.35������������N2��H2����̬��NH3����Һ̬��
��4����Ӧ���Ǵӿ����з���������Ĺ����У������������͵����ķе㲻ͬ�����������û�����������ʣ����������仯����Ӧ��̼��ˮ������Ӧ���������ɣ��仯�����������������ɣ����ڻ�ѧ�仯����Ӧ���ǵ����������ڸ��¸�ѹ�����������������ɰ������仯�����У������������ʣ����ڻ�ѧ�仯��ͼ��������Ģ٢ڢ۵ı仯�У��������������仯�Ĺ������٣����ݹ������̿�֪����������ѭ��ʹ�õ������ǵ�����������
��5�����ݹ������̿�֪�������������ڸ��¸�ѹ�����������������ɰ�������ѧ����ʽΪ��N����3H2 ![]() 2NH3��
2NH3��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ���±�����������ˮ���ұ��IJ������ݡ�
��������ˮˮ�ʳ��������Ŀ����ֵ�����֣�
��Ŀ | ��ֵ |
ɫ�� | ������15�ȣ������ó���������ɫ |
���Ƕ� | ������1�ȣ���������²�����5�� |
pH | 6.5��8.5 |
��Ӳ�ȣ���CaCO3�ƣ� | 450mg/L |
�� | 0.2mg/L |
�� | 0.3mg/L |
������ | 250mg/L |
�����С�����ָ����_______��ѡ����ʡ���Ԫ�ء���ԭ�ӡ�)��
��������Ӳˮ�����ķ�����________ ������֪����ˮ��Ӳˮ������ˮ���ɼ���________ �����顣
��Cl2��ClO2����������ˮ��������������Ԫ�صĻ��ϼ۷ֱ���____________��
��1L�ϸ����������ˮ�У�����CaCO3����Ӳ�ȣ����Ԫ�صĺ���������____mg/L��
��ʵ����������ˮ��ͨ��ֽ⣬���������������������ԼΪ_______����Ӧ�Ļ�ѧ����ʽΪ ��________��
�������ϵ���ˮ������Ȼ�ܴ���ˮ���٣�����ˮ��Դ��ÿ������Ӧ�������κ����������о�һ����Լ��ˮ�ĺ������飺_________��