题目内容
【题目】1909年,化学家哈伯用氮气和氢气在高温高压条件下首次合成了氨气,反应原理是N2+3H2![]() 2NH3。氨气具有可燃性,燃烧时发热量高。近年科学家发现用催化剂在常温下就能合成氨气,使其有望成为替代氢能的新一代能源。
2NH3。氨气具有可燃性,燃烧时发热量高。近年科学家发现用催化剂在常温下就能合成氨气,使其有望成为替代氢能的新一代能源。
(1)氨气中氮元素的化合价是___;氨气中氮元素与氢元素的质量比为____。
(2)若用下面三幅模型图表示合成氨气的过程,则从反应开始到完成的排列顺序是_____(用字母表示)。

(3)氨气燃烧时可能会生成氮氧化物而污染环境,但在一定条件下,氨气燃烧却没有任何污染,该反应原理是:4NH3+3O2![]() 2X+6H2O,其中X是________。
2X+6H2O,其中X是________。
【答案】-3 14:3 acb N2
【解析】
(1)化合物中各元素的化合价的代数和为零,氨气中氢元素的化合价为+1,设氮元素的化合价为x,则x+(+1)×3=0,x=-3,故填-3;
氨气中氮元素与氢元素的质量比为14:(1×3)=14:3,故填14:3。
(2)反应开始时有氢分子与氮分子,然后分子被分成原子,原子再重新组合成新分子——氨分子,故填acb。
(3)由质量守恒定律知,反应前后原子质量和数目不变,化学方程式的前面有4个氮原子,12个氢原子和6个氧原子,后面有12个氢原子和6个氧原子,缺少的4个氮原子在2X中,每个X中由2个氮原子,X的化学式为N2,故填N2。

 优学名师名题系列答案
优学名师名题系列答案【题目】同学们利用“硫酸、硝酸铵、氢氧化钠、碳酸钾”四种物质的溶液进行探究学习,完成下列各问:
(实验探究)
(1)A、B、C、D四组同学分别进行了下列实验
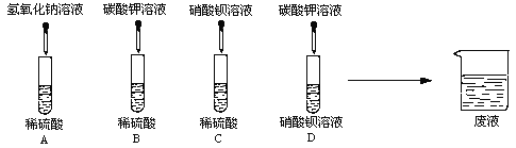
写出下列的两个化学方程式:
①A中的反应______________________
②D中的反应_____________________________
(挖掘实质)
下图是A组反应的微观过程示意图该化学反应的实质可以表示为H++OH-=H2O
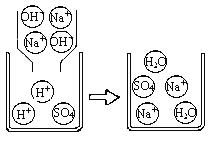
(实践运用)
完成试验后,四组同学将废液倒入同一个烧杯中,再将废液过滤,得到无色溶液和白色沉淀,用无色溶液滴加紫色石蕊试剂,变为红色。
(1)①溶液中的白色沉淀一定是______________________,理由:___________________________
(2)废液中一定含有的离子是____________________,一定不含有的离子是_______________________
(3)为了验证该溶液中可能含有的离子是否存在,我设计如下实验进行验证
溶液中可能含有的离子 | 实验步骤 | 实验现象 | 实验结论 |
可能含有_________ | ②取滤液滴______________ | 现象明显 | 含有该离子 |
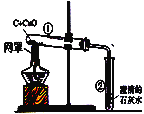
【题目】空气是一种宝贵资源,如利用空气中分离出的氮气合成氨气,合成氨对社会发展和人类进步做出了巨大贡献,下列是合成氨的工艺流程图:
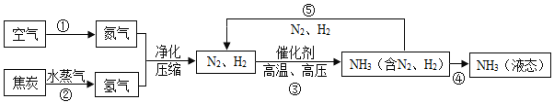
(1)空气属于____(填“纯净物”或“混合物”),空气中氮气的体积分数约为 __%。
(2)用化学用语填空
两个氢分子____ 标出NH3中氮元素的化合价______
氦气__________ 步骤③的反应中没有改变的微粒是__
(3)将沸点不同的气体分离开来,常采用液化分离法。如控制温度在﹣183℃时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,温度应该控制在___℃。
物质 | H2 | N2 | O2 | NH3 |
沸点 | ﹣252℃ | ﹣195.8℃ | ﹣183℃ | ﹣33.35℃ |
(4)图中所标出的①②③的变化中,其中属于物理变化的过程是____,流程中能循环使用的物质是___(填名称)。
(5)写出N2、H2反应生成NH3的化学方程式_________。