题目内容
【题目】某化学小组对人体吸入的空气和呼出气体进行了如下实验探究。
(提出问题)人体吸入的空气与呼出气体组成有什么不同?
(资料)①白磷着火点约40℃;②通常条件下,氢氧化钠溶液与白磷不反应,氢氧化钠溶液可以吸收二氧化碳气体。
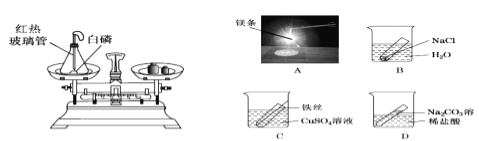
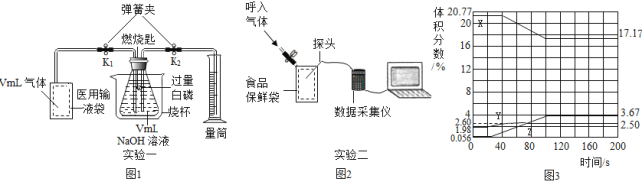
(实验操作)实验一:(如图1)
(1)检查好装置气密性后装入试剂,医用输液袋中收集VmL空气。
(2)打开弹簧夹_______,缓慢将袋中空气全部排入锥形瓶中,读出量筒内收集到液体V1mL.由此测得空气中_____的体积为______mL。
(3)关闭弹簧夹K1、K2,再用_____方法(填具体操作),使燃烧匙内的白磷迅速燃烧,反应的化学方程式为________。充分反应后,冷却至室温,打开K2,量筒内剩余液体为V2mL。由此测得氧气在空气中所占的体积分数可表示为_____。
实验二:(如图2)
(4)把测定氧气、二氧化碳、水蒸气的传感器放入食品保鲜袋,然后向袋内呼出气体。采集的数据经处理如图3所示,表示氧气体积分数变化的_____。(填“X”、“Y”或“Z”)。Y的体积分数在60s之后逐渐减小的原因是_________。
(数据处理)(5)实验二中,200s时没有被采集数据的其他所有气体的总体积分数为____%。
(评价与反思)(6)由实验二分析,人体呼出气体与空气相比,组成上的差异是__________。
【答案】K1、K2 CO2 V-V1 加入热水(热水温度大于40℃) 4P + 5O2![]() 2P2O5
2P2O5 ![]() X 水蒸气冷凝 76.66 氧气含量比空气低,二氧化碳、水蒸气含量比空气高
X 水蒸气冷凝 76.66 氧气含量比空气低,二氧化碳、水蒸气含量比空气高
【解析】
(2)打开弹簧夹K1、K2;缓慢将袋中的空气全部排入锥形瓶中。读出量筒中液体体积为V1 mL,氢氧化钠溶液易与二氧化碳反应生成可以溶于水的碳酸钠和水,锥形瓶中氢氧化钠溶液的作用是吸收气体中的二氧化碳,减少的液体体积等于二氧化碳体积,二氧化碳的体积=V﹣V1;
(3)关闭弹簧夹K1、K2,再向烧杯中加入热水(热水温度大于40℃),以促使白磷迅速燃烧。磷燃烧产生五氧化二磷,化学反应式为4P + 5O2![]() 2P2O5;待瓶中气体冷却至室温,打开K2。量筒中的水倒吸,读出量筒中液体体积为V2mL,反应消耗的氧气体积= V1- V2,测定出的气体成分在空气中所占的体积分数可表示=
2P2O5;待瓶中气体冷却至室温,打开K2。量筒中的水倒吸,读出量筒中液体体积为V2mL,反应消耗的氧气体积= V1- V2,测定出的气体成分在空气中所占的体积分数可表示= ![]() ×100%;
×100%;
(4)由于呼出气体中二氧化碳增多和水蒸气增多,氧气减少。把氧气、二氧化碳、水蒸气(测湿度)探头放入袋中,开始采集数据(如图1),然后向袋内吹入气体,采集的数据经处理得到图3,表示氧气体积分数变化的是X,Y的体积分数在60s后逐渐减小的原因是水蒸气冷凝;
(5)由图示可知:200s时未采集数据的所有气体,总体积分数=100%-17.17%-3.67%-2.50%=76.66%;
(6)人体的新陈代谢需要消耗氧气,同时产生二氧化碳,因此呼出气体中所含的氧气的含量比人体吸入空气中氧气含量低,二氧化碳的含量比人体吸入空气中的二氧化碳多。

 春雨教育同步作文系列答案
春雨教育同步作文系列答案【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?

I.小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。

(1)请写出过氧化氢分解的反应方程式:______________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到__________,说明生成的气体是氧气。
II.小林查阅了相关资料,并进行了探究实验
(查阅资料)
(1)过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | _____ |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液 第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是___________。
(4)实验②中第一次收集到的氧气体积为__________ mL。
(5)实验②中横线部分应进行的操作是__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/ ℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/ mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是__________。
【题目】空气是一种宝贵资源,如利用空气中分离出的氮气合成氨气,合成氨对社会发展和人类进步做出了巨大贡献,下列是合成氨的工艺流程图:
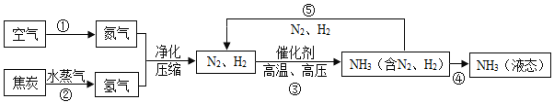
(1)空气属于____(填“纯净物”或“混合物”),空气中氮气的体积分数约为 __%。
(2)用化学用语填空
两个氢分子____ 标出NH3中氮元素的化合价______
氦气__________ 步骤③的反应中没有改变的微粒是__
(3)将沸点不同的气体分离开来,常采用液化分离法。如控制温度在﹣183℃时,可将空气中N2与O2分离。根据下表中物质的沸点判断,要将产物NH3与N2、H2分离开来,温度应该控制在___℃。
物质 | H2 | N2 | O2 | NH3 |
沸点 | ﹣252℃ | ﹣195.8℃ | ﹣183℃ | ﹣33.35℃ |
(4)图中所标出的①②③的变化中,其中属于物理变化的过程是____,流程中能循环使用的物质是___(填名称)。
(5)写出N2、H2反应生成NH3的化学方程式_________。
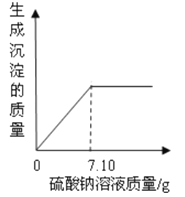
【题目】如下表中数据为氯化钠和硝酸钾在不同温度时的溶解度,如图所示是用其中一种物质所做的实验。下列分析正确的是( )

温度(℃) | 10 | 20 | 30 | 40 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
A. 实验中加入的物质R是氯化钠 B. ④中t的取值范围在30~40之间
C. ③中的溶液可能是饱和溶液 D. ④中溶液的溶质质量分数可能比②中的大