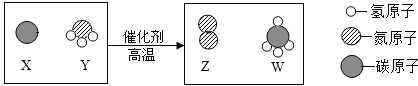
题目内容
【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题1)该样品中含有哪些物质?
(提出猜想)猜想Ⅰ:全部是NaOH;
猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3。
(实验探究1)为确定该样品成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
①取少量样品溶于水,加入 足量的________; | 白色沉淀产生 | 该反应的化学方程式为 ________ |
②将上述反应后的混合液过滤, 取滤液加入________; | ________ | 证明猜想Ⅲ成立 |
(提出问题2)怎样提纯该样品得到纯净的氢氧化钠固体?
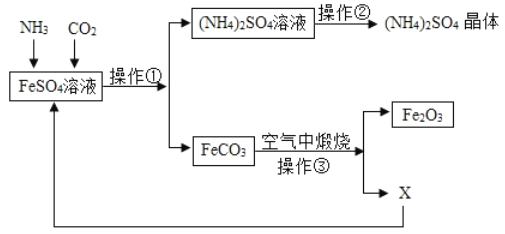
(实验探究2)为得到纯净的氢氧化钠固体,设计的实验过程如下图。请回答下列问题

⑴长期暴露在空气中的氢氧化钠固体样品极易变质,原因是________(用化学方程式表示)。操作B的名称为________,所需的玻璃仪器有________、烧杯和玻璃棒。
⑵该实验中发生反应的化学方程式为________。
⑶最终所得氢氧化钠固体质量________(选填“<”、“=”或“>”)变质后样品中氢氧化钠的质量。
(实验探究3)为了测定NaOH的纯度,某同学设计如图装置。
已知:CO2在饱和碳酸氢钠溶液中几乎不溶解。

⑷B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是________。
⑸取10g样品进行实验,根据实验数据,通过计算可知产生了CO20.44g,求原样品中NaOH的质量分数,写出计算过程_____________。
【答案】 氯化钡溶液 BaCl2+Na2CO3=BaCO3↓+2 NaCl 酚酞 红 2NaOH+ CO2= Na2CO3+H2O 过滤 漏斗 Ba(OH)2+Na2CO3=BaCO3↓+2 NaOH > 二氧化碳能够溶于水 89.4%
【解析】本题在氢氧化钠的变质后的成分及含量的探究的情境下,考查了碱、盐的化学性质和根据化学方程式的计算。
实验探究1:若猜想Ⅲ成立,则溶液存在碳酸钠和氢氧化钠。氯化钡溶液和碳酸钠反应生成白色沉淀碳酸钙和氯化钠,可用足量的氯化钡溶液检验碳酸钠并完全除去碳酸钠。氢氧化钠呈碱性,能使酚酞变红色,再用酚酞检验氢氧化钠的存在。因此:
实验操作 | 实验现象 | 实验结论 |
①取少量样品溶于水,加入足量的氯化钡溶液; | 白色沉淀产生 | 该反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl |
②将上述反应后的混合液过滤,取滤液加入酚酞; | 溶液变红 | 证明猜想Ⅲ成立 |
实验探究2:
⑴氢氧化钠变质是与二氧化碳反应生成碳酸钠和水;反应方程式为:2NaOH+ CO2= Na2CO3+H2O;操作B得到固体和溶液,所以操作B是过滤;所需的玻璃仪器有漏斗、烧杯和玻璃棒;
⑵碳酸钠能与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,能除去杂质且没有引入新的杂质,方程式为Ba(OH)2+Na2CO3=BaCO3↓+2NaOH;
⑶根据反应看出,变质生成的碳酸钠通过反应生成氢氧化钠,最终所得氢氧化钠固体质量比变质后样品中氢氧化钠的质量多,故填“>”;
⑷本题的实验目的是通过测量二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳能够溶于水,所以用饱和的碳酸氢钠水溶液,可以避免二氧化碳溶于水;
⑸设:样品中含碳酸钠的质量为x。
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 0.44g
![]() 解之得:x=1.06g。
解之得:x=1.06g。
样品中碳酸钠的质量分数=![]() ×100%≈89.4%。
×100%≈89.4%。

 名校课堂系列答案
名校课堂系列答案【题目】碳酸钡广泛用于陶瓷、光学玻璃等行业。有一种碳酸盐矿石,其主要成分是碳酸钡和碳酸钙,现以此矿石为原料生产碳酸钡,并得到副产品氢氧化钙,其流程如下图所示:
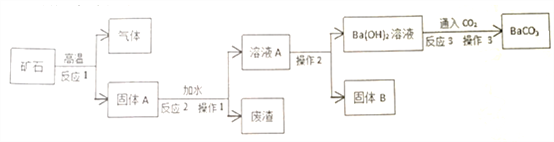
已知,氢氧化钡和氢氧化钙在不同温度下的溶解度是:
温度/℃ | 0 | 40 | 80 |
氢氧化钡溶解度/g | 1.67 | 8.22 | 101.4 |
氢氧化钙溶解度/g | 0.187 | 0.141 | 0.094 |
请回答
(1)碳酸钡与碳酸钙的化学性质相似,高温下能分解成两种氧化物,碳酸钡在高温下分解的化学方程式为______________。
(2)氧化钡与氧化钙的化学性质相似,能与水反应。溶液A中存在的阳离子是___________(写离子符号)。
(3)在实验室里完成操作1,需要用到的玻璃仪器除漏斗、玻璃棒外,还有______________。
(4)操作2采用的操作方法依次为____________(填序号)。
A.过滤 B.降温 C.加热 D.蒸馏 E.灼烧
(5)反应3的化学方程式为___________________________________________。
(6)废渣要经过洗涤后才能弃渣,原因是________________________。
(7)假设该碳酸盐矿石中含有40%的碳酸钙,那么50kg该矿石理论上可制得氢氧化钙的质量是________kg。