题目内容
【题目】铜是人类最早利用的金属之一。 冶炼铜常用铜矿石——孔雀石,其主要成分为碱式碳酸铜[Cu2(OH)2CO3],生成铜的简要流程如下:
(查阅资料)碱式碳酸铜是一种绿色的不溶于水的固体,受热易分解,从组成上分析,它兼备碱和碳酸盐的化学性质,所以能与酸发生反应。
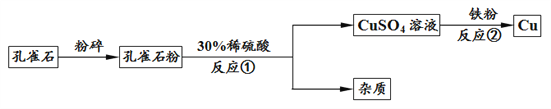
(1)反应前,将孔雀石粉碎的目的是_________________________。
(2)写出反应②的化学方程式_____________________。
(3)反应①后进行的操作名称是__________,若所得CuSO4溶液为浑浊的,则可能的原因是___________(写一种即可)。
(4)反应①除生成CuSO4外,还生成了两种氧化物,其化学式分别为_________、__________。
【答案】 增大反应物之间的接触面积,加快反应速率 Fe + CuSO4 == FeSO4 + Cu 过滤 滤纸破损 或液面高于滤纸边缘 H2O 、 CO2
【解析】(1)根据增大反应物之间的接触面积,加快反应速率解答;(2)根据铁与硫酸铜反应生成铜和硫酸亚铁解答;(3)根据分离固体和液体的操作是过滤解答;根据过滤操作中的失误分析解答;(4)根据碱式碳酸铜与稀硫酸反应生成硫酸铜、水和二氧化碳解答。(1)反应前,将孔雀石粉碎的目的是增大反应物之间的接触面积,加快反应速率;(2)铁与硫酸铜反应生成铜和硫酸亚铁,反应的化学方程式为Fe +CuSO4 = FeSO4 + Cu;(3)反应①后进行的操作是将固体和液体分离,故该操作的名称是过滤;若所得CuSO4溶液为浑浊的,则可能的原因是滤纸破损(或液面高于滤纸边缘);(4)反应①是碱式碳酸铜与稀硫酸反应生成硫酸铜、水和二氧化碳,除生成CuSO4外,还生成了两种氧化物,其化学式分别为H2O和CO2。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
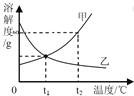
ABC考王全优卷系列答案【题目】下表是不同温度时硝酸钾的溶解度,有关说法正确的是( )
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/克 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
A. 20℃时,100克硝酸钾饱和溶液中含硝酸钾31.6克
B. 40℃时硝酸钾饱和溶液中,溶质硝酸钾的质量分数为63.9%
C. 100℃的水能溶解的硝酸钾一定比80℃的水能溶解的硝酸钾多
D. 100℃时(100+246)克硝酸钾饱和溶液降温到60℃时,析出硝酸钾固体的质量为136克
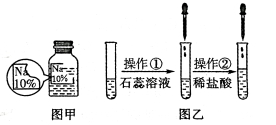
【题目】(7分)某同学在实验室发现了一瓶标签残缺的无色溶液﹙如图甲所示﹚,为确认其中的溶质,他设计并进行了如下探究活动,请回答下列问题。
【猜想与假设】其溶质可能为NaCl、NaOH、Na2CO3和NaHCO3中的一种。
【资料查阅】上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下某稀溶液的pH | 7 | 13 | 11 | 9 |
【探究过程】
如图乙所示,在操作①后可确定溶质不是NaCl,则其实验现象应是 ;
在进行操作②时有无色无味得到气体产生,由此又可排除假设物质中的 。
【探究结论】
你认为该溶液中的溶质可能是上述假设物质中的 ,你的判断依据是 。
【探究反思】
(1)若上述探究结论是正确的,操作②产生的气体应是 (写化学式),实验室检验该气体的实验操作及现象是 。
(2)另有同学猜想其中的溶质还可能是Na2SO4,但又没有Na2SO4的上述表列信息。
请你根据以上实验操作的相关现象,判断该溶液中的溶质是否是Na2SO4,并叙述理由: 。
【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题1)该样品中含有哪些物质?
(提出猜想)猜想Ⅰ:全部是NaOH;
猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3。
(实验探究1)为确定该样品成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
①取少量样品溶于水,加入 足量的________; | 白色沉淀产生 | 该反应的化学方程式为 ________ |
②将上述反应后的混合液过滤, 取滤液加入________; | ________ | 证明猜想Ⅲ成立 |
(提出问题2)怎样提纯该样品得到纯净的氢氧化钠固体?
(实验探究2)为得到纯净的氢氧化钠固体,设计的实验过程如下图。请回答下列问题

⑴长期暴露在空气中的氢氧化钠固体样品极易变质,原因是________(用化学方程式表示)。操作B的名称为________,所需的玻璃仪器有________、烧杯和玻璃棒。
⑵该实验中发生反应的化学方程式为________。
⑶最终所得氢氧化钠固体质量________(选填“<”、“=”或“>”)变质后样品中氢氧化钠的质量。
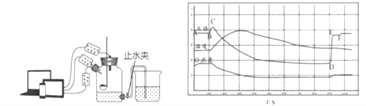
(实验探究3)为了测定NaOH的纯度,某同学设计如图装置。
已知:CO2在饱和碳酸氢钠溶液中几乎不溶解。

⑷B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是________。
⑸取10g样品进行实验,根据实验数据,通过计算可知产生了CO20.44g,求原样品中NaOH的质量分数,写出计算过程_____________。