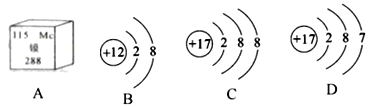
题目内容
【题目】某化工厂排放的废水含有较多FeSO4,为综合利用FeSO4,他们设计一下工艺流程:
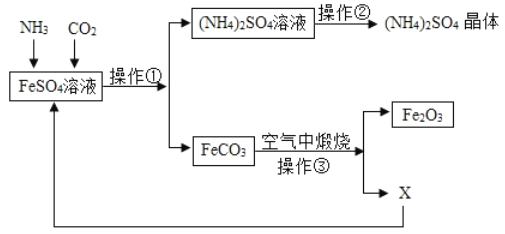
(1)操作![]() 的名称是 ______ ,其中用到的玻璃仪器有玻璃棒、烧杯和 ______ ,
的名称是 ______ ,其中用到的玻璃仪器有玻璃棒、烧杯和 ______ ,
(2)在上述流程图中使物质中元素的化合价发生改变的是操作_____
(3)整个实验流程中可以循环利用的物质是 ______ (用名称表示);煅烧生成的Fe2O3可用于工业炼铁,其反应的化学反应方程式为 ______ .
(4)该工艺流程中制取的(NH4)2SO4在农业上可以用作 ______ .
【答案】 过滤, 漏斗 ③ 二氧化碳 Fe2O3+3CO![]() 2Fe+3CO2 氮肥
2Fe+3CO2 氮肥
【解析】(1)操作①是用来分离沉淀和液体的方法,是过滤操作,过滤需要用到的玻璃仪器是漏斗、烧杯、玻璃棒;(2)据图分析,只有在步骤三中铁有+2价变成+3价,其他步骤中,元素的化合价没有改变;(3)根据质量守恒定律可知,碳酸亚铁煅烧生成氧化铁和二氧化碳;在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,可以循环利用的物质是二氧化碳;反应的化学反应方程式为:Fe2O3+3CO![]() 2Fe+3CO2;(4)硫酸铵中含有农作物所需要的氮元素,在农业上可以用作氮肥。
2Fe+3CO2;(4)硫酸铵中含有农作物所需要的氮元素,在农业上可以用作氮肥。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末。某兴趣小组的同学对该样品的成分及含量进行了探究。
(提出问题1)该样品中含有哪些物质?
(提出猜想)猜想Ⅰ:全部是NaOH;
猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3。
(实验探究1)为确定该样品成分,小明设计了如下实验方案,请你一起完成下列实验报告。
实验操作 | 实验现象 | 实验结论 |
①取少量样品溶于水,加入 足量的________; | 白色沉淀产生 | 该反应的化学方程式为 ________ |
②将上述反应后的混合液过滤, 取滤液加入________; | ________ | 证明猜想Ⅲ成立 |
(提出问题2)怎样提纯该样品得到纯净的氢氧化钠固体?
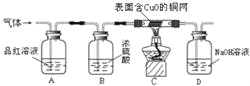
(实验探究2)为得到纯净的氢氧化钠固体,设计的实验过程如下图。请回答下列问题

⑴长期暴露在空气中的氢氧化钠固体样品极易变质,原因是________(用化学方程式表示)。操作B的名称为________,所需的玻璃仪器有________、烧杯和玻璃棒。
⑵该实验中发生反应的化学方程式为________。
⑶最终所得氢氧化钠固体质量________(选填“<”、“=”或“>”)变质后样品中氢氧化钠的质量。
(实验探究3)为了测定NaOH的纯度,某同学设计如图装置。
已知:CO2在饱和碳酸氢钠溶液中几乎不溶解。

⑷B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由是________。
⑸取10g样品进行实验,根据实验数据,通过计算可知产生了CO20.44g,求原样品中NaOH的质量分数,写出计算过程_____________。
【题目】物质的组成与构成
(1)请按要求填写下列表格
物质名称 | 化学式 | 物质组成(元素符号) | 物质构成(微粒符号) |
蔗糖 | _____ | _____ | _____ |
二氧化硫 | _____ | _____ | _____ |
碳 | _____ | _____ | _____ |
氢氧化钠 | _____ | _____ | _____ |
硫酸铜溶液 |
| _____ | _____ |
(2)通过对比和比较获得结论是化学学习中重要的方法和手段。请按要求填空:
H2O、H2O2和NH3 | 相似之处: ①_______________________________________ ②_______________________________________ |
| 不同之处: ①_______________________________________ ②_______________________________________ |