题目内容
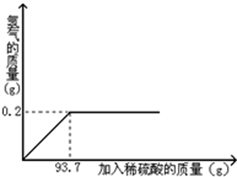
某工厂欲用2%的稀硫酸测定本厂排放的废水中氢氧化钾的含量(废水中的其他物质不与稀硫酸反应)。试计算:向盛有20 g废水的锥形瓶中逐滴滴加2%的稀硫酸,至恰好完全反应。将实验所得数据绘制成如图所示图像。求废水中氢氧化钾的质量分数。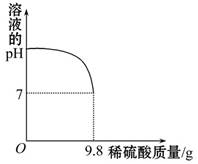

1.12%
由图像可以看出,加入9.8 g稀硫酸时,硫酸与氢氧化钾恰好完全反应,根据硫酸的质量可以求出氢氧化钾的质量,从而再求出废水中氢氧化钾的质量分数。
稀硫酸中溶质的质量为9.8 g×2%=0.196 g。
设参加反应的氢氧化钾的质量为x。
2KOH+H2SO4=K2SO4+2H2O
112 98
x 0.196 g
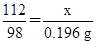 x=0.224 g
x=0.224 g
废水中氢氧化钾的质量分数为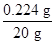 ×100%=1.12%。
×100%=1.12%。
稀硫酸中溶质的质量为9.8 g×2%=0.196 g。
设参加反应的氢氧化钾的质量为x。
2KOH+H2SO4=K2SO4+2H2O
112 98
x 0.196 g
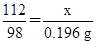 x=0.224 g
x=0.224 g废水中氢氧化钾的质量分数为
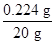 ×100%=1.12%。
×100%=1.12%。
练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目

 3X+4H2O为动力来源.
3X+4H2O为动力来源.