题目内容
某锌样品15g加入50g稀硫酸中(杂质既不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为64.6g。试计算:
(1)生成氢气的体积。(精确到0.1L,在标准状况下氢气的密度为0.9g/L)
(2)锌粒中所含锌的质量分数(精确到0.1%)。
(1)生成氢气的体积。(精确到0.1L,在标准状况下氢气的密度为0.9g/L)
(2)锌粒中所含锌的质量分数(精确到0.1%)。
(1)0.4L
(2)86.7%
(2)86.7%
试题分析:根据题意,锌与稀硫酸反应生成硫酸锌和氢气:Zn + H2SO4 = ZnSO4 + H2↑,依据质量守恒定律化学反应前后物质的总质量不变,则减少的质量为反应生成的氢气的质量,根据氢气的密度可求出生成氢气的体积是0.4L;利用化学方程式中锌与氢气的质量比,结合氢气的质量,可求出样品中锌的质量。
解:根据质量守恒定律,生成氢气的质量=15.0g+50.0g-64.6g=0.4g
氢气的体积为:0.4g÷0.9g/L=0.4L
设锌粒中含锌的质量为x 。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
X 0.4g
65/2=X/0.4g
X=13g
锌粒中所含锌的质量分数="13g÷15g" ×100%=86.7%
答:生成氢气的体积为0.4L,锌粒中锌的质量分数为86.7%。

练习册系列答案
相关题目
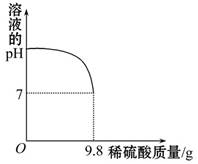

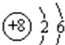 是,下列说法不正确的是 .
是,下列说法不正确的是 .