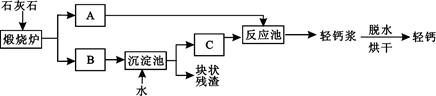
题目内容
黄铜是铜和锌的合金,可以用来制造机器、电器零件及日用品。为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示。
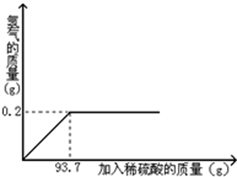
(1)完全反应后,生成H2的质量为 g。
(2)完全反应后所得溶液的溶质质量分数是多少
(保留一位小数)?

(1)完全反应后,生成H2的质量为 g。
(2)完全反应后所得溶液的溶质质量分数是多少
(保留一位小数)?
(1)0.2 (2)16.1%
试题分析:(1)由图可知,氢气的质量为0.2g;
(2)依据质量守恒定律,利用化学方程式,带入氢气的质量可求出金属锌的质量及反应后溶质硫酸锌的质量,在利用溶质质量分数的计算,可求出所得溶液的溶质质量分数。
解:设锌的质量为x ,硫酸锌的质量为y
Zn+H2SO4 =ZnSO4 + H2 ↑
65 161 2
x y 0.2g
65/2=x/0.2g x=6.5g
161/2=y/0.2g y=16.1g
反应后溶液的溶质质量分数="16.1g/(6.5g+93.7g-0.2g)=16.1%"

练习册系列答案
相关题目
 Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。
Na2SO4+2H2O+2NH3↑; 2NH3+H2SO4=(NH4)2SO4。