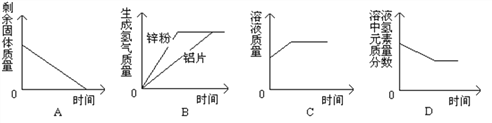
��Ŀ����
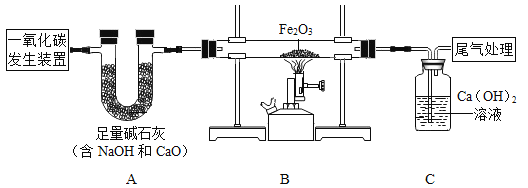
����Ŀ��ijʵ��С��Ϊ̽����Ļ�ѧ���ʣ��ɼס��ҡ���ͬѧ��Ʋ��������ͼ��ʾ��ʵ�顣
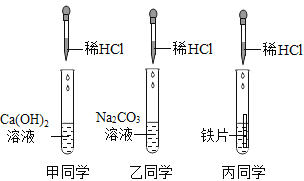
��1����ͬѧʵ������������Ӧ�Ļ�ѧ����ʽΪ______________����ͬѧʵ���Թ��еķ�Ӧ����Ϊ______________��
[��������] CaCl2��NaCl ����Һ�����ԣ�Na2CO3��Һ�Լ��ԡ�
[ʵ�鱨��һ ]ȷ���ס���ͬѧ����ʵ���������Һ�е����ʡ�
��2��ȡ��������Һ����������ʯ����Һ����Һ�Ժ�ɫ����������Һ��һ�����е�������_____________��д��ѧʽ��
��3��ȡ��������Һ�����������̪��Һ����Һ�Ժ�ɫ����������Һ��һ�����е�������______________����д��ѧʽ��
[ʵ��̽����]ȷ���ס���ͬѧ����ʵ��������Һ��Ϻ�ijɷ֡�
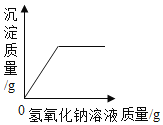
��4���ס���ͬѧ������ʵ��������Һ����ͬһ��Һ���У��۲쵽�������ݲ��������а�ɫ�������ɡ�ͬѧ�ǽ��ձ��ڵ����ʽ��й��ˣ���������Һ�����ʳɷֽ���̽����
��ͬѧ����: NaCl��
��ͬѧ����:NaC1��CaCl2��
��ͬѧ����: NaCl��CaCl2��HCl��
��IJ���:______________��
[��������]
��5������Ϊ_____________ͬѧ�IJ���һ ������ȷ�� ������______________��
[���ʵ��]�����ʵ��֤����IJ� ����ȷ��
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У������еμ�_____________�� | ______________�� | ��������� |
���𰸡�![]() ������ð������Һ����ɫ��dz��ɫ CaCl2�� HC1 NaCl��Na2CO3 NaC1�� Na2CO3 �� ��HC1�������а�ɫ�������� ��ɫ��̪��Һ ��Һ���ɫ
������ð������Һ����ɫ��dz��ɫ CaCl2�� HC1 NaCl��Na2CO3 NaC1�� Na2CO3 �� ��HC1�������а�ɫ�������� ��ɫ��̪��Һ ��Һ���ɫ
��������
��1����ͬѧʵ������������Ӧ���������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ����Ӧ�Ļ�ѧ����ʽΪ![]() ����ͬѧʵ���У�����ϡ���ᷴӦ����dz��ɫ���Ȼ�������Һ�����������Թ��еķ�Ӧ�����ǣ�������ð������Һ����ɫ��dz��ɫ��
����ͬѧʵ���У�����ϡ���ᷴӦ����dz��ɫ���Ȼ�������Һ�����������Թ��еķ�Ӧ�����ǣ�������ð������Һ����ɫ��dz��ɫ��
��2���������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ��ȡ��������Һ����������ʯ����Һ����Һ�Ժ�ɫ�������ԣ��ʼ�������Һ��һ�����е�������CaCl2�� HC1��
��3��̼���ƺ�ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��ȡ��������Һ�����������̪��Һ����Һ�Ժ�ɫ���Լ��ԣ�����������Һ��һ�����е�������NaCl��Na2CO3��
��4���ס���ͬѧ������ʵ��������Һ����ͬһ��Һ���У��۲쵽�������ݲ��������а�ɫ�������ɣ��ð�ɫ������̼��ƣ����Ȼ�����̼���Ʒ�Ӧ����̼��ư�ɫ�������Ȼ��ƣ�
��ͬѧ����: NaCl��
��ͬѧ����:NaC1��CaCl2��
��ͬѧ����: NaCl�� CaCl2��HCl��
��̼���ƹ���ʱ��ϡ�������Ȼ�����ȫ��Ӧ����Һ����NaC1�� Na2CO3�����ҵIJ��룺NaC1�� Na2CO3��
��5����ͬѧ�IJ���һ������ȷ��������������Ͳ����а�ɫ������
ʵ��֤���ҵIJ��룺ȡ������Һ���Թ��У������еμ���ɫ��̪��Һ����Һ���ɫ���������������ȡ������Һ���Թ��У������еμ��Ȼ�����Һ���а�ɫ�������ɣ������������