题目内容
【题目】完成下列计算(除不尽的数据,保留小数点后两位数据):
(1)乙二酸(HOOC﹣COOH)中O元素的质量分数为_____.
(2)t℃下,将20gNaCl投入80g水,充分搅拌,刚好形成了饱和溶液,如果在t℃下继续向上述溶液中投入20gNaCl并充分搅拌,则所得溶液的溶质质量分数为_____.
(3)某同学为了测定双氧水中溶质的质量分数,用烧杯取双氧水溶液50克,加入二氧化锰1克,完全反应后,称得烧杯内剩余物的总质量为49.4克.则该双氧水中的溶质质量分数是___?(写出解题过程).
【答案】71.11% 20% 该双氧水中的溶质质量分数是6.8%
【解析】
![]()
(1)乙二酸(HOOC﹣COOH)中O元素的质量分数为![]()
(2)由于t℃下,将20gNaCl投入80g水,充分搅拌,刚好形成了饱和溶液,如果在t℃下继续向上述溶液中投入20gNaCl,后加入的氯化钠不再溶解,所得溶液的溶质质量分数为![]()
(3)根据质量守恒定律可知,生成氧气的质量为![]()
设该双氧水溶液中的溶质质量为x,根据题意得
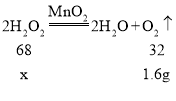
![]()
![]()
过氧化氢溶液中过氧化氢溶质的质量分数为![]()

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
【题目】请补全表格,并根据如表回答有关问题.[除第(2)小题外,其余均用序号填写]
序号 | ① | ② | ③ | ④ |
物质 | ______ | 高锰酸钾 | 熟石灰 | 干冰 |
化学式 | C2H5OH | KMnO4 | ______ | CO2 |
(1)如表中的物质属于氧化物的是______.
(2)用表中的物质作为反应物,写出符合下列要求的化学方程式:
①实验室制取氧气______;
②实验室检验④______。
(3)温度升高,溶解度减少的是______.