题目内容
【题目】有关金属的性质。
I. 把一定质量的锌粉投入到硫酸亚铁和硫酸铜的混合溶液A中,充分搅拌,过滤。回答下列问题。
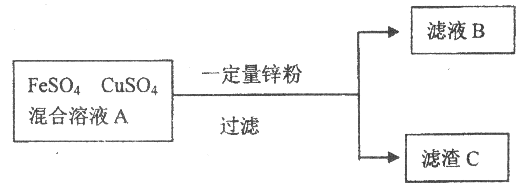
(1)若向滤渣C中加入适量稀硫酸,有气体生成。滤渣C中一定有____________,滤液B中除水外,一定有___________。
(2)若向溶液A中加入过量的锌粉,写出向滤渣C中加入足量硫酸,发生的反应的化学方程式为__________________。
II. 为了验证金属活动性强弱和验证质量守恒定律,同学们设计了如图所示的实验。
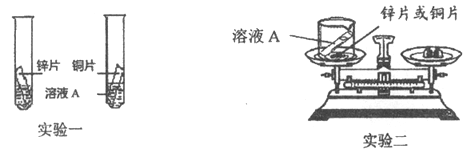
(1)利用实验一和实验二,既能验证铜、锌金属活动性强弱,同时能验证质量守恒定律,则溶液A可以是_________(填序号)。
a. 稀硫酸 b. 硝酸银溶液 c. 氯化亚铁溶液 d. 硫酸锌溶液 e. 硫酸铜溶液
(2)利用以上试剂设计反应,验证铜和银的金属活动性,化学反应方程式为_________,现象为_________。
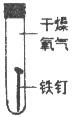
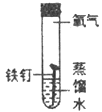
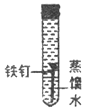
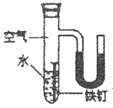
III. 某同学为了探究铁钉生锈条件,设计了如下实验。
序号 | ① | ② | ③ | ④ |
实验内容 |
|
|
|
|
实验现象 | 铁钉无明显变化 | 铁钉生锈 | 铁钉无明显变化 | 铁钉生锈 |
(1)通过实验①、②对比得出的结论是_________。
(2)实验④中,一段时间后,观察到U型管左侧液面_________(填“上升”、“不变”或“下降”),原因是_________。
【答案】 Cu Fe, ZnSO4 H2SO4+Fe=FeSO4+H2↑ H2SO4+Zn=ZnSO4+H2↑ c e Cu+2AgNO3=Cu(NO3)2+2Ag 铜片表面有银白色固体析出,溶液由无色变为蓝色 铁钉生锈的条件之一是铁钉与水接触 上升 铁钉生锈,消耗氧气,装置内压强小于外界大气压,所以U型管左侧液面上升
【解析】(1)锌与硫酸亚铁和硫酸铜都有反应,但是由于铁比铜活泼,故锌先与硫酸铜反应,后与硫酸亚铁反应,只要有反应进行,就有铜生成,反应后向滤渣中加入稀盐酸,有气泡冒出,则一定有铁,可能有锌,滤液中一定有硫酸锌,可能有硫酸亚铁;
(2)当锌过量时,说明滤渣中一定有锌和铁,故反应方程式为H2SO4+Fe=FeSO4+H2↑、H2SO4+Zn=ZnSO4+H2↑;
II.(1)a、锌粒和稀硫酸反应由气体生成,故不能验证质量守恒定律,错误;b锌和铜都不和硝酸银反应,故不能鉴别,错误;c锌可以把硫酸亚铁中的铁置换出来,而铜不能,说明锌比铜活泼,该反应中没有气体生成,可以在敞口容器中进行探究质量守恒定律实验,正确; d锌和铜都不与硫酸锌反应,不能鉴别,错误;e锌可以把硫酸铜中的铜置换出来,说明锌比铜活泼,该反应中没有气体生成,可以在敞口容器中进行探究质量守恒定律实验,正确。故选ce
(2)铜可以与硝酸银反应生成银和硝酸铜,反应方程式为
Cu+2AgNO3=Cu(NO3)2+2Ag;
III.(1)①中铁没有与水接触,不生锈,②中铁与水接触,有生锈,说明铁钉生锈的条件之一是铁钉与水接触;
(2)铁钉有水和氧气反应,耗掉了氧气,故管内的压强降低,故左液面上升;

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
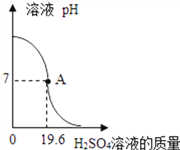
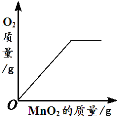
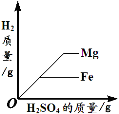
暑假作业安徽少年儿童出版社系列答案【题目】下列4个图像能正确反映对应变化关系是
A | B | C | D |
|
|
|
|
向盛有一定量的H2O2溶液的烧杯中加入MnO2 | 向盛有一定量碳酸钙粉末的烧杯中加入稀盐酸 | 向等质量的镁、铁两种金属,分别放入同浓度的稀硫酸 | 引燃密闭集气瓶中的木炭 |
【题目】在一次用餐中,同学们对燃料“固体酒精”产生了好奇,于是对其成分进行研究。
【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成.
(2)氯化钙、氯化钡溶液均呈中性.
【提出问题】(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
【实验探究】(1)按图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论.此结论_____________(选填“合理”或“不合理”).
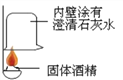
(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀.取沉淀与试管中加稀盐酸,有气泡产生.写出产生沉淀的化学方程式____________.分析实验并结合资料得出氢氧化钠已变质.
(3)为进一步确定氢氧化钠的变质程度,分组探究.
①甲组取烧杯上层清液于两支试管中,按下图探究.
方案 |
|
|
现象 | 溶液变红 | 产生______________ |
结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
②乙组认为甲组实验不能证明清液中一定有氢氧化钠,理由是 ____________.他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后滴加酚酞溶液,酚酞溶液变红.
【实验结论】经讨论一致认为固体酒精中的氢氧化钠部分变质.
【反思交流】乙组实验中加足量氯化钡溶液的目的是 ____________
【拓展应用】要除去部分变质的氢氧化钠溶液中的杂质,可选择适量的____________ .(填序号)
A.Ba(OH)2溶液 B.CaCl2溶液 C.Ca(OH)2溶液