题目内容
【题目】取100g一定质量分数的Ba(OH)2溶液于烧杯中,逐渐加入质量分数为20%的H2SO4溶液.实验过程中,溶液的pH与加入H2SO4溶液的质量关系如图所示.
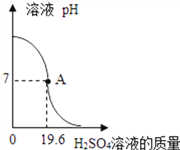
(1)Ba(OH)2中钡元素的质量分数为________,当加入9.8gH2SO4溶液时,溶液的pH________(填“大于”“小于”或“等于”)7
(2)计算Ba(OH)2溶液中溶质的质量分数为________(写出计算过程)
【答案】 80.1% 大于 6.84%
【解析】(1)Ba(OH)2中钡元素的质量分数为: ![]() ×100%=80.1%;由图中信息可知,当加入19.6g稀硫酸时,稀硫酸恰好和氢氧化钡完全反应,当加入9.8gH2SO4溶液时,氢氧化钡过量,溶液的pH大于7;
×100%=80.1%;由图中信息可知,当加入19.6g稀硫酸时,稀硫酸恰好和氢氧化钡完全反应,当加入9.8gH2SO4溶液时,氢氧化钡过量,溶液的pH大于7;
(2)设氢氧化钡的质量为x,
Ba(OH)2+H2SO4═BaSO4↓+2H2O
171 98
x 19.6g×20%
![]() =
=![]()
x=6.84g,
Ba(OH)2溶液中溶质的质量分数为: ![]() ×100%=6.84%,
×100%=6.84%,
答:Ba(OH)2溶液中溶质的质量分数为6.84%。

【题目】有关金属的性质。
I. 把一定质量的锌粉投入到硫酸亚铁和硫酸铜的混合溶液A中,充分搅拌,过滤。回答下列问题。
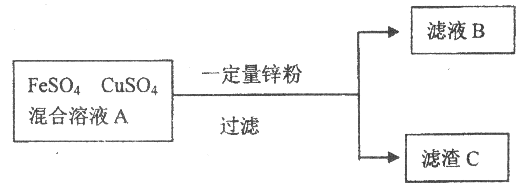
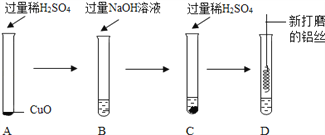
(1)若向滤渣C中加入适量稀硫酸,有气体生成。滤渣C中一定有____________,滤液B中除水外,一定有___________。
(2)若向溶液A中加入过量的锌粉,写出向滤渣C中加入足量硫酸,发生的反应的化学方程式为__________________。
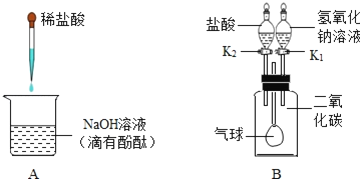
II. 为了验证金属活动性强弱和验证质量守恒定律,同学们设计了如图所示的实验。
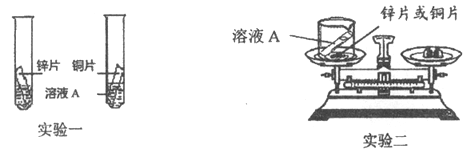
(1)利用实验一和实验二,既能验证铜、锌金属活动性强弱,同时能验证质量守恒定律,则溶液A可以是_________(填序号)。
a. 稀硫酸 b. 硝酸银溶液 c. 氯化亚铁溶液 d. 硫酸锌溶液 e. 硫酸铜溶液
(2)利用以上试剂设计反应,验证铜和银的金属活动性,化学反应方程式为_________,现象为_________。
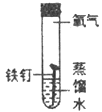
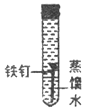
III. 某同学为了探究铁钉生锈条件,设计了如下实验。
序号 | ① | ② | ③ | ④ |
实验内容 |
|
|
|
|
实验现象 | 铁钉无明显变化 | 铁钉生锈 | 铁钉无明显变化 | 铁钉生锈 |
(1)通过实验①、②对比得出的结论是_________。
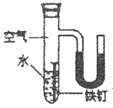
(2)实验④中,一段时间后,观察到U型管左侧液面_________(填“上升”、“不变”或“下降”),原因是_________。