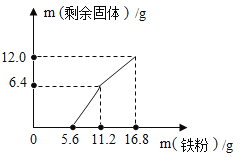
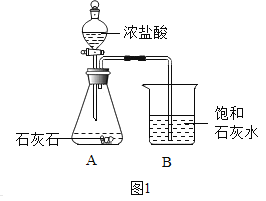
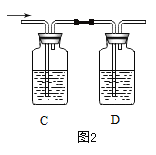
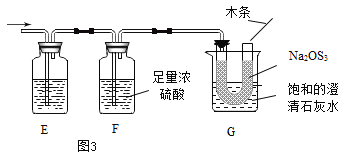
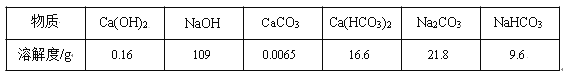
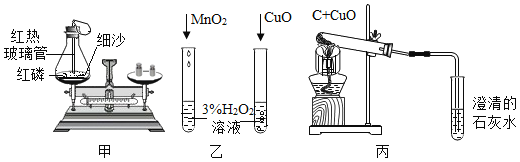
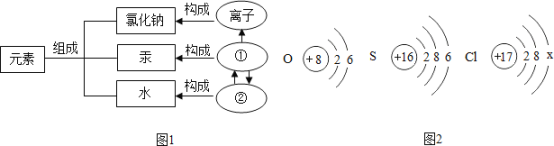
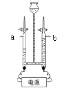
题目内容
【题目】有一包白色粉末样品,可能由 NaCl、Na2SO4、Na2CO3、CuSO4中的一种或几种组成。某同学为测定该样品的组成,做如下实验:
Ⅰ.取少量样品,加水溶解得无色溶液;
Ⅱ.另取少量粉末样品,滴加稀盐酸,无明显现象。
(1)由上述实验可推测样品中一定不含有上述物质中的 ____________(写化学式)。
(2)为进一步确定样品的组成,另取少量样品按下图所示步骤进行实验:
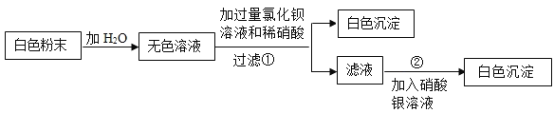
则样品中一定含有的物质是 ____________;反应①的化学方程式为 ____________。
【答案】Na2CO3、CuSO4 Na2SO4 ![]()
【解析】
(1)取样品溶于水得无色溶液,而CuSO4 溶液是蓝色的,所以样品中无CuSO4。向样品中加入稀盐酸,无明显实验现象,排出碳酸钠的存在,因为碳酸钠与稀盐酸反应有气泡产生。故由上述实验可推测样品中一定不含有上述物质中的Na2CO3、CuSO4。
(2)加入过量氯化钡溶液和稀硝酸,产生白色沉淀,则样品中一定含有Na2SO4,因为发生反应:Na2SO4+BaCl2=BaSO4↓+2NaCl,BaSO4难溶于水稀硝酸。滤液中加入硝酸银溶液,产生白色沉淀,证明滤液中含有氯离子,但因为①中加入氯化钡溶液,故反应后的滤液中含有氯离子,无法判断氯离子的来源,不能确定氯化钠是否存在。故样品中一定含有的物质是Na2SO4;反应①的化学方程式为:![]()

 阅读快车系列答案
阅读快车系列答案【题目】一包白色粉末A由Na2SO4、NaOH、Ba(OH)2、BaCO3、 MgC12五种物质中的两种或多种混合而成。为探究其组成,进行如下图所示的实验: (假设 实验过程中所发生的反应均恰好完全反应)
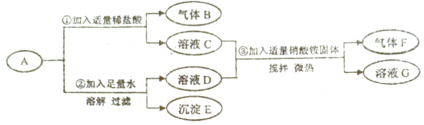
依据实验过程和出现的现象请你回答下列问题:
(1)气体F的化学式是_______。
(2)写出步骤①中生成气体B的化学方程式:______。
(3)在溶液C和溶液G中,一定都存在的阴离子是_____(写离子符号)。
(4)固体混合物A中,肯定不存在的物质有______种。若要进一步推理A的组成,可用溶液D再做实验确定可能含有的物质:
实验操作 | 实验现象 | 实验结论 |
取溶液D少许,滴加Na2SO4溶液,震荡 | 有白色沉淀生成 | ______ |