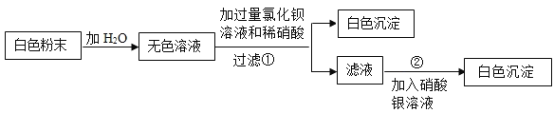
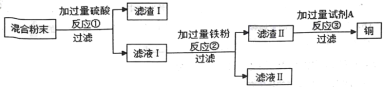
题目内容
【题目】已知某金属粉末由铝、镁、锌、铁、铜中的多种组成。某学生取该样品2.4g,向其中加入50g一定溶质质量分数的稀硫酸,恰好完全反应,固体全部溶解,得到了52.2g无色溶液。则下列判断正确的是
A.该金属样品的组成可以是镁或者铝和锌或者铝、镁和锌
B.该金属样品中一定不含有铜和铁
C.所加入的稀硫酸的溶质质量分数为9.8%
D.所得溶液中溶质总质量为12g
【答案】ABD
【解析】
铝和稀硫酸反应生成硫酸铝和氢气,镁和稀硫酸反应生成硫酸镁和氢气,锌和稀硫酸反应生成硫酸锌和氢气,铁和稀硫酸反应生成硫酸亚铁和氢气。
A、取该样品2.4g,向其中加入50g一定溶质质量分数的稀硫酸,恰好完全反应,固体全部溶解,得到了52.2g无色溶液,则该金属样品中一定不含有铜和铁,生成的氢气的质量为![]() ,铝、镁、锌和稀硫酸反应的关系式为
,铝、镁、锌和稀硫酸反应的关系式为![]() ,
,![]() ,
,![]() ,2.4g样品全部为铝时,生成的氢气的质量为0.27g,2.4g样品全部为镁时,生成的氢气的质量为0.2g,2.4g样品全部为锌时,生成的氢气的质量为0.07g,则该金属样品的组成可以是镁或者铝和锌或者铝、镁和锌,故A正确;
,2.4g样品全部为铝时,生成的氢气的质量为0.27g,2.4g样品全部为镁时,生成的氢气的质量为0.2g,2.4g样品全部为锌时,生成的氢气的质量为0.07g,则该金属样品的组成可以是镁或者铝和锌或者铝、镁和锌,故A正确;
B、铜和稀硫酸不反应,铁和稀硫酸反应生成硫酸亚铁,硫酸亚铁溶液是浅绿色的,加入50g一定溶质质量分数的稀硫酸,恰好完全反应,固体全部溶解,得到了52.2g无色溶液,则该金属样品中一定不含有铜和铁,故B正确;
C、由质量守恒定律可知,反应前后元素的种类和质量不变,取该样品2.4g,向其中加入50g一定溶质质量分数的稀硫酸,恰好完全反应,固体全部溶解,得到了52.2g无色溶液,则生成的氢气的质量为![]() ,参加反应的稀硫酸的质量为
,参加反应的稀硫酸的质量为![]() ,所加入的稀硫酸的溶质质量分数为
,所加入的稀硫酸的溶质质量分数为![]() ,故C不正确;
,故C不正确;
D、样品的质量为2.4g,加入的稀硫酸的溶质质量为9.8g,生成的氢气的质量为0.2g,所得溶液中溶质总质量为![]() ,故D正确。故选ABD。
,故D正确。故选ABD。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案