题目内容
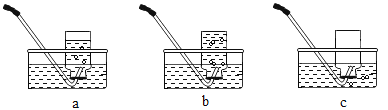
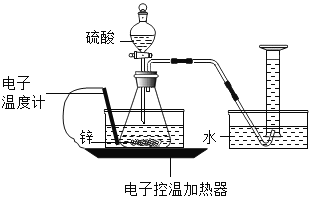
【题目】某实验小组的同学对“锌与硫酸反应速率的影响因素”进行探究,并利用如图装置收集产生的氢气。
(查阅资料)
圆粒状锌的直径通常为 3-4 毫米,粉末状锌的直径通常为 0.3-0.5 毫米。
(进行实验)
实验 1:在不同温度下,进行锌与硫酸反应的实验。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
1-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
1-2 | 30 | 20 | 10% | 圆粒状 | 1 | 134 |
1-3 | 40 | 20 | 10% | 圆粒状 | 1 | 107 |
实验 2:在相同温度下,继续进行锌与硫酸反应速率的影响因素的探究。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
2-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
2-2 | 20 | 20 | 10% | 粉末状 | 1 | 47 |
2-3 | 20 | 20 | 20% | 圆粒状 | 1 | 88 |
2-4 | 20 | 20 | 20% | 粉末状 | 1 | 26 |
(解释与结论)
(1)锌与硫酸反应的化学方程式为_____ 。
(2)能用排水法收集氢气的原因是氢气_____(填“易”或“难”)溶于水。
(3)实验 1 的目的是_____。
(4)实验 2 中,欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比的实验_____(填编号)。
(5)实验 2 中,通过对比 2-1 和 2-2,得出的结论是_____。
(反思与评价)
(6)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为_____。
(7)实验室中若使用 6.5g 锌粒制取氢气,理论上制得氢气的质量为_____g。
【答案】Zn+ H2SO4 =ZnSO4 + H2↑ 难 探究温度对锌与硫酸反应速率的影响 2-1与2-3(或2-2与2-4) 其他条件相同时,锌与硫酸接触面积越大反应速率越快 使用锌粉反应速率过快,不利于控制反应 0.2
【解析】
[解释与结论]
(1)锌与硫酸反应生成硫酸锌和氢气,化学方程式为Zn+ H2SO4 =ZnSO4 + H2↑;
(2)能用排水法收集氢气的原因是氢气难溶于水;
(3)实验1中 ,形成对照的实验间,只有温度不同,其他影响反应速率的因素都相同,故目的是探究温度对锌与硫酸反应速率的影响;
(4)实验 2 中,欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比的实验是只有硫酸浓度不同,其他都相同的实验2-1与2-3(或2-2与2-4);
(5)实验 2 中,对比2-1和 2-2中,只有锌粒的形状不同,即锌与酸的接触面积不同,且颗粒越小,锌与酸的接触面积越大,反应越快,得出的结论是其他条件相同时,锌与硫酸接触面积越大反应速率越快;
[反思与评价]
(6)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为使用锌粉反应速率过快,不利于控制反应;
(7)实验室中若使用 6.5g 锌粒制取氢气,设理论上制得氢气的质量为x,则: ![]()
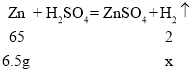
![]() x=0.2g
x=0.2g

 阅读快车系列答案
阅读快车系列答案【题目】把A、B、C、D四种物质放在密闭容器中,在一定条件下充分反应,并测得反应物和产物在反应前后各物质的质量如表所示:
物质 | A | B | C | D |
反应前质量 |
|
|
|
|
反应后质量 | 待测 |
| 0 |
|
下列说法正确的是![]()
A. 物质C一定是反应物,物质D可能是单质
B. 反应后密闭容器中A的质量为![]()
C. 反应过程中,物质B和物质D变化的质量比为87:36
D. 若物质A与物质C的相对分子质量之比为194:216,则反应中A和C的化学计量数之比为2:1