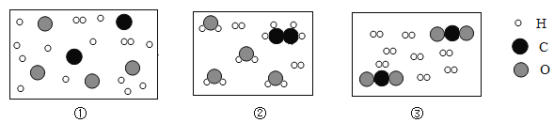
题目内容
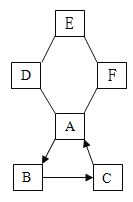
【题目】甲、乙两化工厂分布在某排污渠两岸(如图所示),箭头代表水流方向。若甲厂附近a处水样经检测含有的阴离子是OH-、SO42- ,c处水样经检测pH=7且只含有少量的NaCl,则乙厂排放到b处水中的物质可能是( )
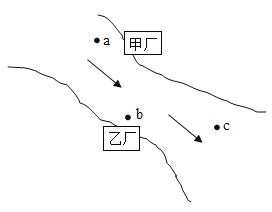
A.BaCl2、HC1
B.H2SO4、Ba(NO3)2
C.MgSO4、NaCl
D.BaCl2、Mg(NO3)2
【答案】A
【解析】
A、a处水样经检测含有的阴离子是OH-、SO42- ,c处水样经检测pH=7且只含有少量的NaCl,如果b处水中的物质是氯化钡、HCl,a处是氢氧化钠和硫酸钠,则氢氧化钠和盐酸反应生成氯化钠和水,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,如果恰好完全反应,则c处只有氯化钠,且pH=7,符合题意;
B、如果b处水中的物质是H2SO4、Ba(NO3)2,氢离子能与氢氧根离子结合成水,钡离子能与硫酸根离子结合成硫酸钡沉淀,但是硝酸根离子无法形成沉淀,故c处一定含硝酸根离子,与事实不符,不符合题意;
C、如果b处水中的物质是MgSO4、NaCl,镁离子可以和氢氧根离子结合成氢氧化镁沉淀,硫酸根离子能和钡离子结合成沉淀,但是a处不可能有钡离子,因为钡离子和硫酸根离子不能共存,不符合题意;
D、如果b处水中的物质是BaCl2、Mg(NO3)2,钡离子可和硫酸根离子结合成沉淀,镁离子可和氢氧根离子结合成沉淀 ,但是硝酸根离子无法形成沉淀,故c处一定含硝酸根离子,与事实不符,不符合题意。
故选A。

 夺冠金卷全能练考系列答案
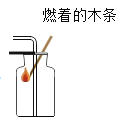
夺冠金卷全能练考系列答案【题目】某实验小组的同学对“锌与硫酸反应速率的影响因素”进行探究,并利用如图装置收集产生的氢气。
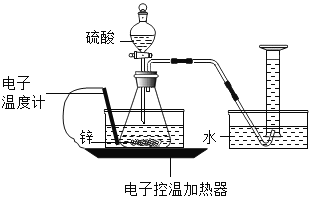
(查阅资料)
圆粒状锌的直径通常为 3-4 毫米,粉末状锌的直径通常为 0.3-0.5 毫米。
(进行实验)
实验 1:在不同温度下,进行锌与硫酸反应的实验。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
1-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
1-2 | 30 | 20 | 10% | 圆粒状 | 1 | 134 |
1-3 | 40 | 20 | 10% | 圆粒状 | 1 | 107 |
实验 2:在相同温度下,继续进行锌与硫酸反应速率的影响因素的探究。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
2-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
2-2 | 20 | 20 | 10% | 粉末状 | 1 | 47 |
2-3 | 20 | 20 | 20% | 圆粒状 | 1 | 88 |
2-4 | 20 | 20 | 20% | 粉末状 | 1 | 26 |
(解释与结论)
(1)锌与硫酸反应的化学方程式为_____ 。
(2)能用排水法收集氢气的原因是氢气_____(填“易”或“难”)溶于水。
(3)实验 1 的目的是_____。
(4)实验 2 中,欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比的实验_____(填编号)。
(5)实验 2 中,通过对比 2-1 和 2-2,得出的结论是_____。
(反思与评价)
(6)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为_____。
(7)实验室中若使用 6.5g 锌粒制取氢气,理论上制得氢气的质量为_____g。