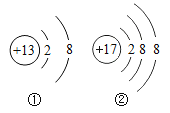
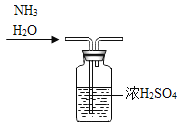
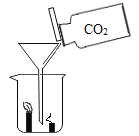
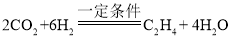题目内容
【题目】实验室利用如图所示装置进行相关实验。
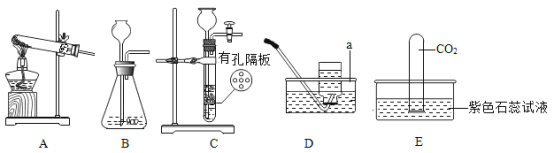
(1)装置D中仪器a的名称是_____。
(2)用一定量氯酸钾和二氧化锰混合加热制取氧气时。
Ⅰ.反应的化学方程式为_____,反应类型是_____ (填“化合”或“分解”)反应。
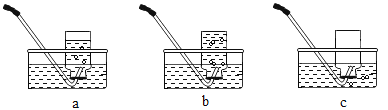
Ⅱ.下图是用D装置收集氧气的过程,依次观察到的现象是_____ (用字母表示)
Ⅲ.实验结束后,经过溶解、_____、 洗涤、 烘干等操作回收二氧化锰。
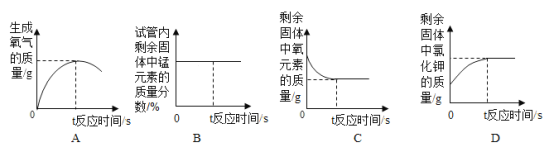
Ⅳ. 反应过程中,能正确表示对应变化关系的图像是_____(填字母编号)。
(3)用块状大理石和稀盐酸制取二氧化碳时。
Ⅰ.可选用发生装置B或_____(填编号);在装置B中依次添加大理石、盐酸,添加盐酸时从长颈漏斗中倒入锥形瓶至_____。
Ⅱ.将收集满二氧化碳气体的试管倒插入紫色石蕊试液中(见上图E装置),并轻轻振荡试管。产生的现象是_____; 反应的化学方程式为_____。
【答案】水槽 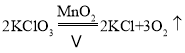 分解 b、a、c 过滤 C C 浸没长颈漏斗下端口 试管内液面上升,紫色石蕊试液变红色
分解 b、a、c 过滤 C C 浸没长颈漏斗下端口 试管内液面上升,紫色石蕊试液变红色 ![]()
【解析】
(1)装置D中仪器a的名称是水槽;
(2)Ⅰ、氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,化学方程式为: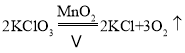 ;该反应是由一种物质生成两种物质的反应,属于分解反应;Ⅱ、排水法收集氧气时,先将集气瓶装满水,倒放在水槽中,然后将导管伸入集气瓶中收集氧气,所以用D装置收集氧气的过程,依次观察到的现象是b、a、c;
;该反应是由一种物质生成两种物质的反应,属于分解反应;Ⅱ、排水法收集氧气时,先将集气瓶装满水,倒放在水槽中,然后将导管伸入集气瓶中收集氧气,所以用D装置收集氧气的过程,依次观察到的现象是b、a、c;
Ⅲ、二氧化锰难溶于水,所以实验结束后,经过溶解、过滤、洗涤、烘干等操作回收二氧化锰;
IV、A、氯酸钾在二氧化锰的催化作用下加热生成氧气和氯化钾,氧气的质量逐渐增大,反应结束后不变,不会出现减小的情况,故A错误;
B、根据剩余固体逐渐减小,锰元素的质量不变,所以锰元素的质量分数逐渐增大,反应结束后不变,故B错误;
C、氯酸钾分解生成了氯化钾和氧气,二氧化锰中也含有氧元素,所以固体中氧元素的质量分数先减小,反应结束后不变,故C正确;
D、剩余固体中氯化钾的质量应该从零开始逐渐增大,故D错误。故选C;
(3)Ⅰ、实验室制取二氧化碳的反应物是固体和液体,反应条件是常温,固体和液体反应制取气体时,需要液封长颈漏斗下端的管口,防止气体逸出,所以可选用发生装置B或C;在装置B中依次添加大理石、盐酸,添加盐酸时从长颈漏斗中倒入锥形瓶,至液面浸没下端管口;
Ⅱ、水和二氧化碳反应生成碳酸,碳酸显酸性,碳酸能使紫色石蕊变红色,所以产生的现象是:紫色石蕊变成红色,试管内液面上升:化学方程式为:![]() 。
。

【题目】某实验小组的同学对“锌与硫酸反应速率的影响因素”进行探究,并利用如图装置收集产生的氢气。
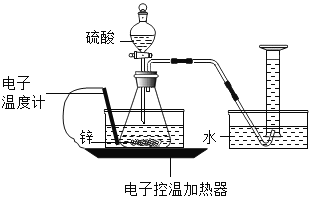
(查阅资料)
圆粒状锌的直径通常为 3-4 毫米,粉末状锌的直径通常为 0.3-0.5 毫米。
(进行实验)
实验 1:在不同温度下,进行锌与硫酸反应的实验。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
1-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
1-2 | 30 | 20 | 10% | 圆粒状 | 1 | 134 |
1-3 | 40 | 20 | 10% | 圆粒状 | 1 | 107 |
实验 2:在相同温度下,继续进行锌与硫酸反应速率的影响因素的探究。
编号 | 温度/℃ | 硫酸体积/ mL | 硫酸溶质质量分数 | 锌的形状 | 锌的质量 /g | 收集30mL氢气所用的时间/s |
2-1 | 20 | 20 | 10% | 圆粒状 | 1 | 170 |
2-2 | 20 | 20 | 10% | 粉末状 | 1 | 47 |
2-3 | 20 | 20 | 20% | 圆粒状 | 1 | 88 |
2-4 | 20 | 20 | 20% | 粉末状 | 1 | 26 |
(解释与结论)
(1)锌与硫酸反应的化学方程式为_____ 。
(2)能用排水法收集氢气的原因是氢气_____(填“易”或“难”)溶于水。
(3)实验 1 的目的是_____。
(4)实验 2 中,欲得出“其他条件相同时,硫酸的溶质质量分数越大,锌与硫酸反应的速率越快”的结论,需要对比的实验_____(填编号)。
(5)实验 2 中,通过对比 2-1 和 2-2,得出的结论是_____。
(反思与评价)
(6)实验室制取氢气时,通常使用锌粒而不用锌粉的原因为_____。
(7)实验室中若使用 6.5g 锌粒制取氢气,理论上制得氢气的质量为_____g。
【题目】一凡同学对生铁的组成进行研究,称取生铁样品 40g,把 500g 稀硫酸分 5 次加入样品中, 测得实验数据见下表:(杂质不溶于水,也不和稀硫酸反应)
实验序号 | 加入稀硫酸的质量/g | 剩余固体的质量/g |
第 1 次 | 100 | 28.8 |
第 2 次 | 100 | 17.6 |
第 3 次 | 100 | M |
第 4 次 | 100 | 1.2 |
第 5 次 | 100 | N |
(1)第 3 次剩余固体的质量 M=_____第 5 次剩余固体的质量 N=_____
(2)该生铁样品中铁的质量分数为_____。
(3)计算第 3 次反应结束后所得溶液的溶质质量分数。_____(写出计算过程,保留一位小数)
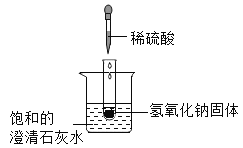
【题目】向一定量的NaOH溶液中慢慢通入CO2气体,看不到明显现象。某实验小组的同学对所得溶液成分进行了如下探究。请你参与他们的探究活动,并完成以下问题:
(提出问题)所得溶液中溶质的成分是什么?
(査阅资料)资料一:将CO2气体慢慢地通入一定量的NaOH溶液中,可能发生以下两个化学反应:
先发生反应:2NaOH+CO2═Na2CO3+H2O
当NaOH反应完全后,继续发生反应:Na2CO3+CO2+H2O═2NaHCO3
資料二;Ca(HCO3)2易溶于水;CaCl2溶液与NaCl溶液均呈中性; NaHCO3溶液呈碱性,可使酚酞溶液变红色。
(猜想与假设)小组同学通过讨论,提出了以下四种猜想
猜想一:溶质为NaOH和Na2CO3
猜想二:溶质全为Na2CO3
(1)你认为猜想三:溶质为_____
猜想四:溶质全为 NaHCO3
(实验探究)小组同学设计并完成了如下实验:
实验步骤 | 实验过程 | 实验现象 | 实验结论 |
① | 取适量反应后的溶液置于试管 中,加入过量CaCl2溶液 | 有白色沉淀生成 | (2)猜想_____不成立 |
② | 取适量步骤①反应后的上层清 液,滴加几滴酚酞溶液 | (3)现象为_____ | 猜想二不成立 |
③ | 取适量步骤①反应后的上层清 液,加入适量稀HCl | 有气泡产生 | (4)猜想_____成立 |
(实验总结)针对上述实验,实验小组的同学总结并写出了上述探究过程中的各步反应方程式。
(5)你认为步骤①发生反应的化学方程式是_____。