题目内容
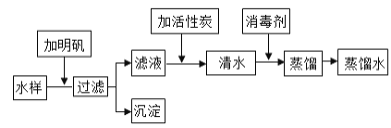
【题目】某品牌矿物质水标签的部分内容如图所示。

(1)氯化钾中氯离子的符号是_________。
(2)硫酸镁中镁离子的结构示意图是_________(填序号)


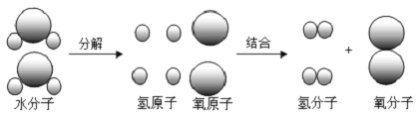
①气体a具有__________性,因此点燃a气体前必须___________。
②水电解的过程中,发生变化的微粒是 _______(填名称,下同),不发生变化的微粒是 _________。
【答案】Cl-C可燃验纯水分子氢原子和氧原子
【解析】
(1)氯化钾中氯元素的化合价是-1价,故氯离子的符号为Cl-。
(2)镁是12号元素,镁离子是由镁原子失去2个最外层电子而形成,故选C。
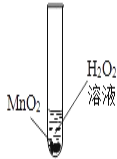
(3)①电解水实验中,与负极相连的电极产生的氢气,与正极相连的电极产生的是氧气,故a 试管中产生的是氢气,具有可燃性。氢气中如果混有氧气的话,点燃易引起爆炸,故点燃前要检验纯度。②电解水的过程中,水分子分裂为氢原子和氧原子,氢原子和氧原子重组为氢气分子和氧气分子,故发生改变的是水分子。不发生变化的微粒是氢原子和氧原子。

【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。
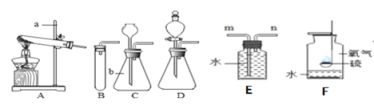
【题目】小明、小强和小峰在学习了“质量守恒定律”后来到化学实验室亲自进行了实验探究,如图是他们分别设计的实验,请你与他们一起进行探究,并回答问题.

实验1:称量镁条,点燃,待反应结束后,再称量.
实验2:将盛有稀盐酸的小试管放入盛有锌粒的烧杯中称量,然后使稀盐酸与锌粒接触,充分反应后再称量.
实验3:将盛有氢氧化钠溶液的小试管放入盛有硫酸铜溶液的锥形瓶中称量,然后使氢氧化钠溶液与硫酸铜溶液混合,充分反应后再称量.
数据见下表:(锌与盐酸反应:Zn+2HCl=ZnCl2+H2↑;氢氧化钠溶液与硫酸铜溶液反应:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4)
编号 | 实验1 | 实验2 | 实验3 |
反应前称量质量 | 9.6g | 212.6g | 118.4g |
反应后称量质量 | 16.0g | 212.4g | 118.4g |
(1)写出实验1反应的化学方程式_____.
(2)上述三个反应_____(填“符合”或“不符合”)质量守恒定律,实验_____正确反映了反应物与生成物的质量关系.
(3)由上述实验我们得到启示,探究_____的反应验证质量守恒定律,实验必须在密闭的装置中进行.
(4)由质量守恒定律可知,化学反应前后,一定不变的是_____(填序号).
①物质种类②元素种类③原子种类④分子种类⑤分子数目⑥原子数目.