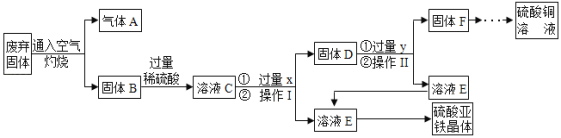
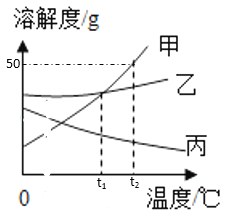
题目内容
【题目】为测定某黄铜(铜锌合金)样品中铜的含量,某化学活动小组分三次进行实验,实验数据如表,请回答下列问题:
所取药品 | 第一次 | 第二次 | 第三次 |
黄铜样品质量(g) | 12 | 10 | 10 |
稀盐酸质量(g) | 100 | 100 | 150 |
生成气体质量(g) | 0.2 | 0.2 | 0.2 |
(1)第____次实验中,药品成分恰好完全反应。
(2)黄铜样品中铜的质量分数是多少?恰好完全反应时所得溶液的溶质质量分数是多少________?(精确到0.1%)
【答案】二;12.8%。
【解析】
(1)根据三次放出氢气的质量都是0.2g及反应物的量进行解答;
(2)根据氢气的质量利用化学方程式求出参加锌和生成的硫酸锌质量,进而计算出黄铜样品中铜的质量分数、所得溶液的溶质质量分数。
(1)依据质量守恒定律可知:三次放出氢气的质量都是0.2g,第一次黄铜样品中的质量多,第三次中稀盐酸质量多,所以第二次取用的稀盐酸和样品恰好完全反应;
(2)设参加反应的锌的质量为x,反应后得到溶液中溶质的质量为y
Zn+2HCl═ZnCl2+H2↑
65 136 2
x y 0.2g
![]()
x=6.5g ,y=13.6g
黄铜样品中铜的质量分数是:
![]()
所得溶液的溶质质量分数是:
![]()
答:黄铜样品中铜的质量分数为35%、所得溶液的溶质质量分数为12.8%。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】如表是 NaCl、NH4Cl 在不同温度时的溶解度。
温度/℃ | 0 | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | |
(1)以上两种物质的溶解度受温度影响较大的是_____。
(2)40℃时,将 40.6g NaCl 加入到 100g 水中,充分搅拌使之溶解,所得溶液的质量为_____g。
(3)20℃时,NaCl 饱和溶液的溶质质量分数为(精确到小数点后 1 位)_____。