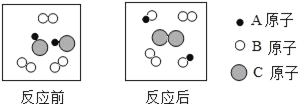
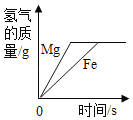
题目内容
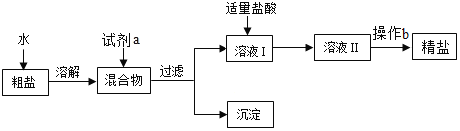
【题目】工业上,常采用“盐硝联产工艺”生产高纯度食盐,还可以制得硫酸钠。卤水中主要含有NaCl,还含有少量Na2SO4、CaSO4、MgSO4、CaCl2、MgCl2、FeCl3,用火碱和烟道气中的CO2为原料净化卤水,符合低碳经济发展要求。分析流程,回答问题:
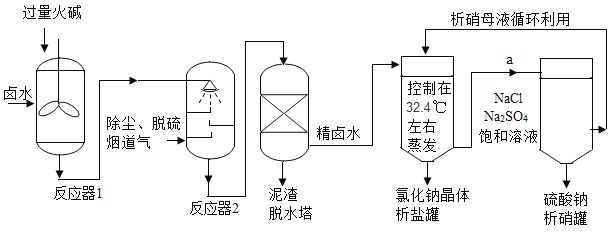
(1)反应器1中主要除去的离子是_____(填符号)。
(2)烟道气通入反应器2前要脱硫,是为了除去有害气体_____ (填化学式)。反应器2中生成沉淀的化学方程式_____ (写一个)。
(3)下表为NaCl和Na2SO4在不同温度时的溶解度:
温度/℃ | 0 | 10 | 20 | 30 | 32.4 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.4 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | 39.0 | 39.8 |
4.9 | 9.1 | 19.5 | 40.8 | 52.0 | 48.8 | 46.2 | 45.3 | 44.3 | 43.7 | 42.7 | 42.5 |
从析盐罐中排出的溶液a,在温度不变的条件下,每10g水中含有NaCl约_____g.为提高Na2SO4纯度,析硝罐中析出Na2SO4,需采用_____ (填“升温”或“降温”)结晶方法。
【答案】Mg2+、Fe3+ SO2 Na2CO3+CaCl2=CaCO3↓+2NaCl 3.64 升温
【解析】
(1)氢氧根离子和镁离子反应会生成氢氧化镁沉淀,和铁离子反应会生成氢氧化铁沉淀,所以反应器1中主要除去的离子是:Mg2+、Fe3+;
(2)二氧化硫有毒,会污染空气,所以烟道气通入反应器2前要脱硫,是为了除去有害气体SO2,二氧化碳和氢氧化钠反应生成碳酸钠和水,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)32.4℃时,氯化钠的溶解度是36.4g,即100g水中最多溶解度36.4g的氯化钠,所以10g水中含有3.64g的氯化钠,原温度为32.4℃,降温的话氯化钠也可能析出,而升温的话,氯化钠溶解度增大,不会析出,硫酸钠的溶解度减小,结晶析出,所以采用升温结晶的方法。

【题目】如图是某品牌的风味酸牛奶及每100g酸牛奶中主要营养成分数据。请回答下列问题。

营养成分 | 蛋白质 | 脂肪 | 糖类 | 钠 | 钙 |
质量 | 3.2g | 3.6g | 11.9g | 60mg | 80mg |
(1)人体必需的六大类基本营养素中,除水外,表中没有标示的营养素是_____。
(2)表中能为人体提供能量的营养素有_____种。
(3)该酸牛奶的外包装是一种塑料制品,随意丢弃会造成“白色污染”。为减少“白色污染”,可采取的措施是_____(答一点)。
(4)酸牛奶中的蔗糖,在胃肠内转化为葡萄糖(C6H12O6)。葡萄糖在酶的催化作用下,与氧气反应生成水和二氧化碳,请写出该反应的化学方程式_____。