题目内容
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4,加入到盛有NaOH溶液的小烧杯中。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是________。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | ___________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【实验结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验结论】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是________________________。
(2)实验方案中也有一个是错误的,错误的原因是___________________________。
【答案】 猜想四 NaOH 产生大量气泡 将pH试纸伸入待测溶液中 BaCl2溶液能与Na2SO4溶液反应产生白色沉淀,不能确定溶液中一定存在H2SO4
【解析】【假设猜想】酸碱之间能发生反应,酸碱不能同时存在。【实验探究】(1)2NaOH + CuSO4 = Cu(OH)2↓+ Na2SO4,丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH。(2)碳酸钠能与稀硫酸反应生成二氧化碳气体而产生大量气泡。【评价反思】(1)实验操作中的错误是将pH试纸伸入待测溶液中,应该用玻璃棒蘸取少量溶液滴在pH试纸上。(2)实验方案中有一个是错误的,错误的原因是BaCl2溶液能与Na2SO4溶液反应产生白色沉淀,不能确定溶液中一定存在H2SO4。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】在学习第十单元《常见的酸和碱》时,九年级1班的同学按照老师的要求做了如图两个实验,①向盛有氢氧化钠溶液的试管中缓缓吹气,②向盛有氢氧化钠溶液的烧杯中滴加过量稀盐酸,结果都没有观察到明显现象。为此同学们分甲、乙两组开展了一系列探究活动。
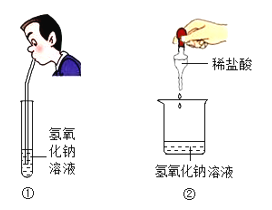
【提出问题】氢氧化钠溶液与二氧化碳和稀盐酸能发生反应吗?
【做出猜想】猜想一:不能发生反应。
猜想二:能发生反应但无明显现象。
【查阅资料】已知通常状况下,1体积的水约能溶解1体积的二氧化碳。
【实验探究】
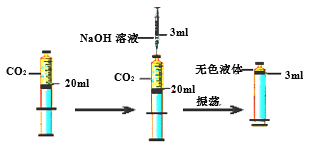
(1)甲组:探究氢氧化钠溶液与二氧化碳能否发生化学反应。
方案一: 向①中得到的液体中滴加某溶液,观察到有气泡产生,说明氢氧化钠溶液能与二氧化碳发生反应,产生该现象的化学方程式是_________。
方案二: 向充满20ml二氧化碳的密闭注射器中注入3ml氢氧化钠溶液,观察到如图现象时,说明二者已反应。请你解释说明该方案是否严谨?________。
(2)乙组:探究氢氧化钠溶液与稀盐酸能否发生化学反应。乙组设计如下实验进行探究。
实验过程 | 实验现象 | 实验结论 | |
方案一 | 取②中得到溶液少许于试管中,滴加几滴硝酸银溶液 | _______ | 氢氧化钠溶液能与稀盐酸发生反应 |
方案二 | 取②中得到的溶液少许于试管中,滴加_______溶液 | 无明显现象 |
【反思与评价】
①通过交流,甲组认为乙组的方案一不太严谨,从微观角度解释原因________。
②乙组同学经过讨论交流后接受了甲组同学的建议,并采用了一种物理方法探究氢氧化钠溶液与稀盐酸反应有新物质生成,该方法可能是______。
【总结与提升】
愉快的探究之旅结束了,留给同学们的不仅仅是化学知识,更获得了解决问题的科学方法。对于无明显现象的化学变化,我们可以通过________的方法探究其反应是否发生。