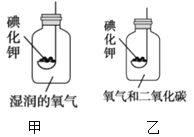
题目内容
【题目】某氢氧化钙粉末中含有碳酸钙杂质。取样品25 g于锥形瓶中,加适量水,搅拌,再滴加稀盐酸,充分反应(化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)后,测得加入稀盐酸的质量与生成气体的质量关系如下图所示。
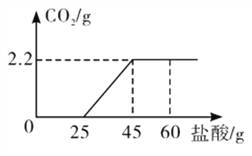
(1)生成二氧化碳的质量是_____________g。
(2)计算样品中碳酸钙的质量分数为______________。
【答案】 2.2 20%
【解析】本题考查了根据化学反应方程式的计算。读懂关系,弄清反应过程是解题的关键。
(1)由题目中图可以看出:当加入稀盐酸的质量为45g时,石灰石中的碳酸钙完全反应且生成二氧化碳的质量为2.2g;
(2)设样品中碳酸钙的质量分数为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
25g×x 2.2g
![]() x=20%
x=20%
答:样品中碳酸钙的质量分数为20%。

 53随堂测系列答案
53随堂测系列答案【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动。请你参与学习并帮助填写空格(包括表中空格)。
【演示实验】将一定量的稀H2SO4,加入到盛有NaOH溶液的小烧杯中。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想。甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。不合理的猜想是________。
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有________。
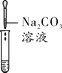
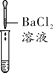
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究。
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | ___________ | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【实验结论】通过探究,全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验结论】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)实验操作中的错误是________________________。
(2)实验方案中也有一个是错误的,错误的原因是___________________________。