题目内容
(11分)有一瓶标签破损的稀硫酸(如右图1), 为测定其溶质质量分数,取出7 g该溶液,加入足量的锌粒,产生氢气的质量与反应时间关系如右图2。请计算:该溶液中溶质的质量分数。
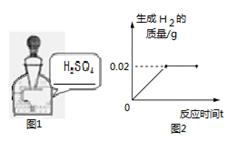
(化学方程式:Zn + H2SO4 ="=" ZnSO4 +H2↑)

(化学方程式:Zn + H2SO4 ="=" ZnSO4 +H2↑)
14%
根据反应的化学方程式,由生成氢气的质量可计算7g溶液中H2SO4的质量,再求出该溶液的溶质质量分数.
解:设7g该溶液中所含溶质的质量为x
Zn+H2SO4= ZnSO4+H2↑
98 2
X 0.02g

X=0.98g
该溶液中 H2SO4的质量分数为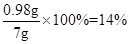
该溶液中溶质的质量分数14%
解:设7g该溶液中所含溶质的质量为x
Zn+H2SO4= ZnSO4+H2↑
98 2
X 0.02g

X=0.98g
该溶液中 H2SO4的质量分数为
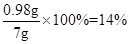
该溶液中溶质的质量分数14%

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目

 4Al +3R↑。
4Al +3R↑。