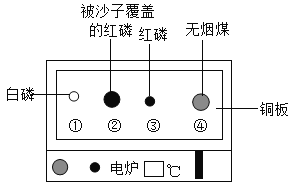
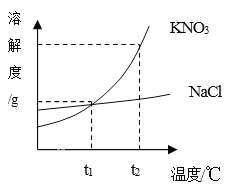
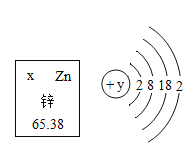
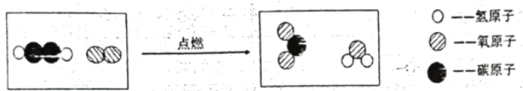
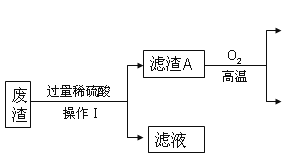
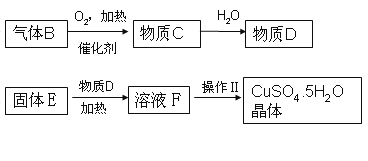
题目内容
【题目】某实验小组的同学在做酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液中加入一定量的稀盐酸后,发现忘了滴加酸碱指示剂,因此,他们停止滴加稀盐酸,并对烧杯中溶液的溶质成分进行探究。
[提出问题]该烧杯中溶液的溶质是什么?
[猜想与假设]同学们提出如下四种猜想:
猜想一:只有CaC l2;
猜想二:含有CaCl2和__;
猜想三:含有CaCl2和HCl;
猜想四:含有CaCl2、HCl和Ca(OH)2。
同学们经过讨论后一致认 为猜想_____不正确,理由是______。
[查阅资料]氯化钙溶液呈中性。
[进行实验]同学们设计了如下实验方案进行探究,请你帮他们填写有关实验步骤及实验现象。
实验方案 | 实验步骤 | 实验现象 |
方案一 | 取少量烧杯中的溶液于试管中,滴加几滴紫色石蕊溶液 | ______ |
方案二 | 取___于试管中,加入一定量的烧杯中的溶液 | 产生气泡 |
方案三 | 取少量烧杯中的溶液于另一只试管中,滴加适量的AgNO3溶液 | 产生白色沉淀 |
[得出结论]猜想三成立。方案二中发生反应的化学方程式为______。
[交流反思](1)老师看过他们的实验报告后指出,方案三不能证明猜想三成立。原因是____。
(2)为了保护环境,需将废液处理之后再排收,可以向烧杯中加入适量的________。
【答案】Ca(OH)2 四 HCl和Ca(OH)2能发生反应,两者不能共存 紫色石蕊溶液变红 适量碳酸钠溶液(合理即可) ![]() 溶液中一定有CaCl2、CaCl2与AgNO3溶液反应有白色沉淀生成,因此不能确定HCl是否存在(合理即可) 熟石灰(合理即可)
溶液中一定有CaCl2、CaCl2与AgNO3溶液反应有白色沉淀生成,因此不能确定HCl是否存在(合理即可) 熟石灰(合理即可)
【解析】
{猜想与假设}氢氧化钙与盐酸反应生成氯化钙和水,反应后溶液中的溶质中一定含有氯化钙,还有可能含有氢氧化钙或盐酸中的一种物质,所以猜想二应该为CaCl2和Ca(OH)2,故填Ca(OH)2;
氢氧化钙与盐酸反应生成氯化钙和水,所以猜想四不正确,故填四;
氢氧化钙与盐酸在同一溶液中发生中和反应生成氯化钙和水,即氢氧化钙与盐酸在同一溶液中不能共存,故填HCl和Ca(OH)2能发生反应,两者不能共存。
{进行实验}方案一:由实验结论知猜想三成立,即溶液中的溶质是氯化钙和盐酸,则溶液呈酸性,滴加几滴紫色石蕊溶液后紫色石蕊溶液变红,故填紫色石蕊溶液变红;
方案二:由实验结论知猜想三成立,即溶液中的溶质是氯化钙和盐酸,盐酸能够与碳酸钠溶液反应生成氯化钠、水和二氧化碳,反应的现象是产生气泡,故填碳酸钠溶液。
{得出结论}方案二中发生的反应是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,故反应的化学方程式写为:Na2CO3+2HCl=2NaCl+H2O+CO2↑。
{交流反思}(1)溶液中一定存在氯化钙,氯化钙中的氯离子能与硝酸银溶液中的银离子反应生成氯化银的白色沉淀,无法确定盐酸是否存在,故填溶液中一定有CaCl2、CaCl2与AgNO3溶液反应有白色沉淀生成,因此不能确定HCl是否存在;
(2)由实验结论知猜想三成立,即溶液中的溶质是氯化钙和盐酸,溶液呈酸性,为了保护环境,可向废液中加入熟石灰将盐酸中和后再排收,故填熟石灰。

【题目】了解日用化工品的成分,有利于我们正确使用。
名称 | 洗洁精 | 炉具清洁剂 | 洁厕灵 | “84”消毒液 |
有效成分 | 表面活性剂 | 氢氧化钠 | 盐酸 | 次氯酸钠 |
(1)洗洁精能清洗餐具上的油污,是因为它具有______功能。
(2)炉具清洁剂的pH___7(填“>”“<”“或“=”)。使用时禁止与皮肤接触是因为氢氧化钠___性.
(3)不能用洁厕灵清洗铁制品的原因是______(用化学方程式表示)。
(4)洁厕灵与“84”消毒液不能混合使用,因为两者混合会发生反应:![]() ,生成的气体X有毒。X的化学式为____。
,生成的气体X有毒。X的化学式为____。